在我們的腸胃道裡,居住著幾億的微生物群(Intestinal microbes),主要由細菌(bacteria)和原生物(protozoa)所組成。這些微生物的數量之多,在成人體內,平均占重2-6磅 (pound),是成人大腦平均重量的兩倍!更驚人的是,這些微生物已經被證實能夠調控宿主的生理時鐘,甚至是基因表現,因此也有「遺忘的器官」(forgotten organ)或是「第二大腦」(second brain)之稱。
腸胃道微生物的組成也被發現會隨著宿主的「作息」變化,由飲食節律調控。一篇在2014年10月發表在《Cell》上的研究顯示,腸胃道微生物的組成不僅有約日節律的變化,且受到宿主生理時鐘的控制,並進一步影響宿主的代謝功能。[5]
在這研究中,研究團隊每六小時所採樣的小鼠糞便,並以生物晶片微陣列(microarray)比對目前已知的微生物序列,發現小鼠內的腸胃道微生物組成有約日節律的變化 (diurnal changes)。有趣的是,當生理時鐘基因PER被突變 (PER-/-)後,微生物的約日節律變化也跟著不這麼明顯了!但若是把突變小鼠體內的微生物,移植到有正常生理時鐘的無菌鼠 (germ-free mice)體內,這些本來約日節律不明顯的微生物菌相又回復了它們的變化。證明了腸道微生物的約日節律變化,會受到宿主的生理時鐘影響 。
由生物晶片微陣列的結果和KEGG (詳列生物體內各種分子調控路徑的資訊平台)的比對顯示,與代謝相關的生化路徑最受影響,因此該團隊推斷宿主的飲食節律(也被生理時鐘調控)是造成腸胃道微生物菌相改變的主因。在這組實驗裡,控制組的小鼠沒有限制進食時間(free feeding); 而實驗組則有兩種不同的進食時間限制:一組小鼠只能在他們的活動期間 (active phase)進食,而另一組小鼠則被限制只能在他們應該休息的時間 (inactive phase)進食。研究團隊發現,活動期間進食的小鼠,與控制組有類似的腸胃道微生物菌相,而休息時間進食的小鼠則在相同時間軸上有著與前述兩組小鼠相反的菌向變化 (anti-phase)。這個結果證明了腸胃道微生物的菌相確實受到宿主的飲食節律的影響。(下圖)
![圖三、腸胃道微生物的菌相受到宿主的飲食節律的影響 左圖是Bacteroides (屬於腸道微生物)在不同時間的多寡變化。ZT (zeitgeber time)是由實驗室所訂的環境時間: ZT 0 是燈亮的時間點 (light phase); ZT12 是燈熄的時間點 (dark phase)。小鼠是夜行性動物,因此藍色是活動期間進食而紅色則是休息時間進食的腸胃道微生物變化。 [5]](http://pansci.asia/wp-content/uploads/2015/04/p3.png)
圖片是Bacteroides (屬於腸道微生物)在不同時間的數量多寡變化。ZT (zeitgeber time)是由實驗室所訂的環境時間: ZT 0 是燈亮的時間點 (light phase); ZT12 是燈熄的時間點 (dark phase)。小鼠是夜行性動物,因此藍色是活動期間進食而紅色則是休息時間進食的腸胃道微生物菌相變化。 [5]
為了證明當宿主的生理時鐘被擾亂時,同樣受到宿主生理時鐘調控的腸胃道微生物,與增高的代謝異常風險有關,研究團隊又設計了新的一組實驗:實驗裡的控制組和所有實驗組,都被餵飼高能量飼料 (hight fat diet, HFD),並透過操作環境的日夜變化給小鼠時差 (jet lag),干擾牠們的生理時鐘。
與先前的研究結果相符,因時差而生理時鐘被擾亂的實驗組,體重增加得比生理時鐘正常的控制組快 ,顯示牠們的脂肪合成與堆積受到影響。令人驚訝的是,當團隊給予實驗組小鼠抗生素,減少牠們的腸胃道微生物時,脂肪代謝異常竟然被抑制,與控制組無異。另外,他們把未處理抗生素的時差組的腸道微生物,移植到在正常日照環境下的無菌鼠體內時,無菌鼠體重在30天內由平均30g 上升到50g!這個實驗證明了,腸道微生物可以把時差的影響「投射」在新的宿主體內。
實驗的最後,該團隊還從剛經歷時差的人採集糞便,並把糞便所含微生物移植到無菌鼠體內,成功地在無菌鼠體內重現了體重快速升高的代謝異常結果。(下圖)
![圖四、腸道微生物投射時差對代謝的影響在新的宿主體內 最左圖是該實驗設計的示意圖: 從計畫飛越跨時區的參與者身上,取得時差前 (黑色),經歷時差一天後 (紅色),和時差後14天 (藍色)的糞便採樣,並將該參與者的腸胃道微生物移植到無菌鼠身上。實驗結果顯示,即使無菌鼠是在無時差的正常光照環境下,期待謝功能如體重與血糖調節能力仍然受到所移植的腸胃道微生物的影響。[5]](http://pansci.asia/wp-content/uploads/2015/04/p4-560x456.jpg)
該實驗設計的示意圖(上),從計畫飛越跨時區的參與者身上,取得時差前 (黑色),經歷時差一天後 (紅色),和時差後14天 (藍色)的糞便採樣,並將該參與者的腸胃道微生物移植到無菌鼠身上。實驗結果顯示,即使無菌鼠是在無時差的正常光照環境下,其代謝功能如體重(下左)與血糖調節能力(下右)仍然受到所移植的腸胃道微生物的影響。[5]
我們是怎麼得到這些微生物呢?
也許很難相信,但是在媽媽生產前,我們在子宮內處於一種接近「無菌」的狀態,是在生產過程中才投過與母親產道接觸 (自然產) 或皮膚接觸 (剖腹產) 接種(colonization)這些微生物。出生後的半年內,微生物的數量和種類會劇烈地增長變化。一年後,這些微生物菌相趨於穩定。[1] 因此,嬰兒時期所接觸到的細菌會決定我們接下來的一生會帶有那些菌群:剖腹生產和自然生產的嬰兒也會帶有不同的菌群;喝母乳的寶寶也會和喝配方奶粉的寶寶有不一樣的菌群,不同的菌群則影響寶寶的抵抗力。
大小鼠因為在接種微生物的過程跟我們很接近,因此被廣作為研究腸胃道微生物影響力的模型(model)。
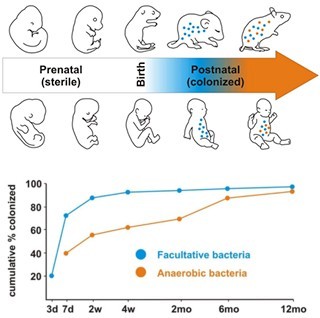
圖中藍色點 (facultative bacteria)和橘色點 (anaerobic bacteria)代表不同品種的細菌。齧齒類 (rodent)和人類一樣,在生產前 (prenatal state),身體內處於無菌的狀態 (sterile state),並於出生時接種,產後(postnatal state)可以看到微生物菌群數量逐漸變多,種類也逐漸多樣化。
在腸道裡的微生物如何控制我們的腦袋?
腸胃道微生物能夠影響人類的生理或心理,比如記憶與學習 [2],焦慮或抑鬱的情緒 [3],和食慾 [4]。既然能夠影響我們的記憶、學習能力、以及心理,腸胃道微生物一定有某些方式可以跟我們的大腦「溝通」。最近的研究讓我們對腸道微生物與大腦的溝通有了更深一層的認識,這些微生物可以透過神經路線(neural pathway)、免疫路線(immunological pathway)和微生物釋放物(gut releasing chemicals)作為與大腦溝通的方式:
神經路線
腸道微生物能夠活化迷走神經(vagus nerve),並將訊息上送至大腦中央神經系統。
免疫路線
另一個腸胃道微生物影響大腦的方式是活化免疫反應。 事實上,這並不讓人意外;腸胃道作為體內接觸外來物的第一線器官,有很多免疫細胞聚集在那裏隨時待命。不正常的腸胃道微生物會造成免疫上的失調,而不正常的免疫活動很早就知道與許多疾病有關聯。
微生物釋放物
腸胃道微生物能釋放的化學物質包括了Ƴ-胺基丁酸(GABA)和色胺酸(tryptophan)。GABA是神經細胞溝通非常重要的神經傳導物,而色胺酸是血清素(serotonin)的前導物(precursor);血清素調控著我們的情緒和食慾。目前有非常多的報告指出,自閉症譜系障礙(Autisim Spectrum Disorder,ASD)患者有不正常的腸胃道微生物菌相。
總結
一直到最近科學家,才得以一窺這個腸內神經系統的網路,對「下移的大腦」嘖嘖稱奇。被擾亂的生理時鐘系統也影響著這個精緻的腸-腦網路。雖然這篇文章所參考的研究,是腸道微生物節律會被宿主的錯誤的生理時鐘干擾,但別忘了,這個網路是雙向溝通的!也就說,腸胃道微生物也有可能反過來影響大腦的生理時鐘。也許有一天,我們能夠減簡單單的喝下優酪乳,透過益生菌減緩甚至治療失眠和時差所帶來的困擾。
參考文獻
- Grenham S, Clarke G, Cryan JF, Dinan TG: Brain–Gut–Microbe Communication in Health and Disease. Frontiers in Physiology 2011, 2:94.
- Hsiao Elaine Y, McBride Sara W, Hsien S, Sharon G, Hyde Embriette R, McCue T, Codelli Julian A, Chow J, Reisman Sarah E, Petrosino Joseph F, et al: Microbiota Modulate Behavioral and Physiological Abnormalities Associated with Neurodevelopmental Disorders. Cell 2013, 155:1451-1463.
- Forsythe P, Sudo N, Dinan T, Taylor VH, Bienenstock J: Mood and gut feelings. Brain, Behavior, and Immunity 2010, 24:9-16.
- Norris V, Molina F, Gewirtz AT: Hypothesis: Bacteria Control Host Appetites. Journal of Bacteriology 2013, 195:411-416.
- Thaiss Christoph A, Zeevi D, Levy M, Zilberman-Schapira G, Suez J, Tengeler Anouk C, Abramson L, Katz Meirav N, Korem T, Zmora N, et al: Transkingdom Control of Microbiota Diurnal Oscillations Promotes Metabolic Homeostasis. Cell 2014, 159:514-529.