筆電大廠聯想、CPU 大廠 Intel 早在 2017 年就提出低溫焊錫製程(LTS),為何需要電子零組件會用到低溫?企業邁向淨零碳排之路,LTS 會成為消費型產品的主流製程嗎?
本文轉載自宜特小學堂〈LTS 製程真的是未來主流嗎〉,如果您對半導體產業新知有興趣,歡迎按下右邊的追蹤,就不會錯過宜特科技的最新文章!
二十世紀起,溫室氣體排放增加導致全球暖化,歐盟在 2005 年已啟動碳排放交易機制,目標是在 2030 年的時候要比 1990 年減碳 55%,在 2050 年要達到碳中和。現在全球有超過 140 個國家包括臺灣,正朝向 2050 年達成淨零碳排努力中。如今剩餘不到 30 年,這場淨零碳排大挑戰,企業扮演了至關重要的角色。

根據統計,電子產品的製程從無鉛製程更改成低溫焊錫製程(Low Temperature Soldering,下稱LTS),SMT(表面黏著)製程的整體費用每年可減少約 40% 成本開銷,二氧化碳排放一年可以減少約 31~57 噸,不論是減碳還是節省成本效益都十分明顯。
 什麼是SMT?
什麼是SMT?
SMT(Surface Mount Technology,又稱表面黏著技術)是一種將電子元件(如電阻、電容和晶體管)安裝到電路板(PCB)表面上的技術。先在電路板上需要焊接的位置印上錫膏,再放上電子元件,然後加熱讓錫膏融化包覆住元件,待冷卻後錫膏固化就完成焊接。

那為什麼我們會預估 LTS 製程將成為未來的主流呢?
根據國際電子製造商聯盟(International Electronics Manufacturing Initiative,簡稱 iNEMI)預測,低溫焊錫(下稱LTS)技術應用產品的佔有率,將從目前低於 1% 提高至 2027 年 20% 以上,這項數據變化顯現了電子產業對環境議題的重視及永續發展的實踐。
近幾年,宜特科技與德凱宜特陸續接到從終端品牌大廠、系統組裝廠、PCB 板廠乃至 CPU、GPU 晶片大廠,都紛紛詢問是否能夠進行 LTS 驗證測試,可見半導體產業鏈上下游都已啟動,代表導入 LTS 已勢在必行。本文由宜特科技與德凱宜特合作,將帶大家深入了解 LTS 製程優勢,及 LTS 在可靠度試驗將面臨的議題。
LTS 製程兩大優勢
LTS 可協助企業降低生產成本
我們先介紹 LTS 的優勢,除了環保節能外成本控管是一大誘因。
(1) 材料成本:由於原先的無鉛製程中,晶片與 PCB 必須滿足溫度範圍 220oC~260oC,因此所選擇材料必須考量到能承受高溫的環境,高於再結晶溫度選擇就是其中之一,但往往就要付出更多成本。如果是選擇低溫錫膏,SMT 就可降低至 140oC~170oC,材料也不用刻意選擇耐受更高溫,選用一般再結晶溫度即可,一來一往晶片與 PCB 都能使用較低成本製作。
(2) SMT 製程縮短:針對需插件式元件,由於本體大多為塑膠材料無法抵抗無鉛製程的溫度,必須選擇波峰焊,導致無鉛 SMT 流程就必須有兩道。如果是選擇 LTS 製程,插件式元件能夠承受 LTS 溫度,SMT 僅需一次就可以把所有元件組裝在 PCB 上,大幅降低工時,以企業角度來看對於成本的控管就能有立竿見影的效果。
LTS 可降低翹曲的發生
異質整合是目前先進製程趨勢,雖然異質晶片雖然具有節省空間、性能提升、功耗降低的種種優點,但複雜的堆疊結構,加上各種晶片的厚度、材料不同,隨之而來會遇到一種常見狀況—翹曲(Warpage)。此狀況,隨著製程溫度上升越明顯,翹曲狀況就更嚴重(如下圖)。
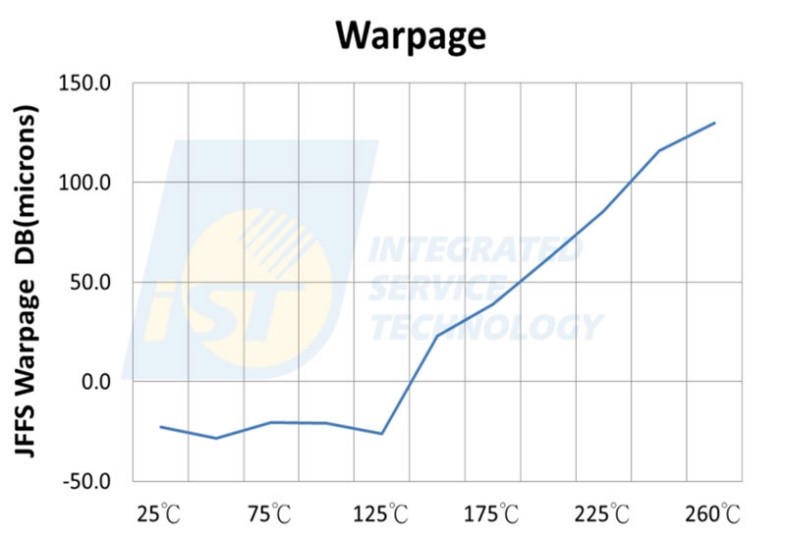
LTS 出現後,翹曲問題似乎就出現了一絲曙光,因為晶片翹曲是依據溫度上升逐漸放大,溫度越高產生的變形也越大,假如 SMT 生產只需一半的溫度時,翹曲是否也只有一半?
答案其實是肯定的,根據宜特與德凱宜特可靠度驗證實驗室的經驗,當樣品尺寸介於 30×30 到 50x50mm 範圍內,140oC~160oC 翹曲的程度相較 240oC~260oC,能夠降低 50~70%。這表示,在不變更任何晶片的設計,透過低溫錫膏就能克服 SMT 過程產生翹曲的現象!
低溫錫膏在可靠度上會遇到問題嗎?
可靠度是為了保障消費者在購買產品後,不受環境或外力的因素並可以正常使用。如果製程更換成低溫錫膏,可靠度是否會有影響呢?
事實上,低溫錫膏在可靠度的確遇到瓶頸,低溫錫膏成分是由錫(Sn)與鉍(Bi)合金組成,但鉍金屬較脆,在應力相關測試時(例如:衝擊與彎曲試驗),會比現今業界常用錫-銀-銅合金稍弱一些,這會使市場不敢大膽地去變更製程材料。不過近年錫膏商會在錫鉍合金中加入第三種或第四種金屬以增加整體強度,其可靠度壽命已經能與錫-銀-銅合金差異不大。
目前針對低溫錫膏的可靠度驗證尚無行業規範,現在已有大廠規範其測試項目主要為兩項,一是溫度循環試驗(Thermal Cycling Test);二是衝擊測試(Shock Test),針對溫度循環試驗,宜特與德凱宜特實驗室在新型低溫錫膏也有初步的驗證結果。介紹如下。
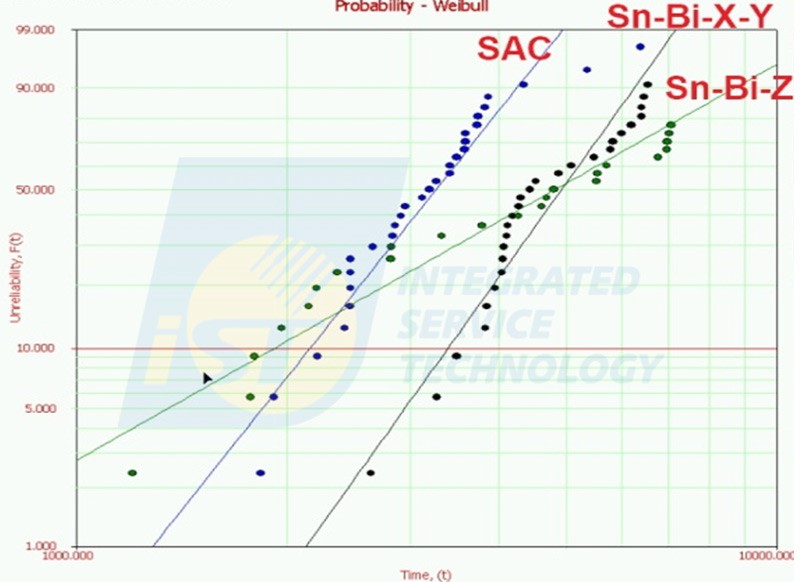
溫度循環試驗:低溫錫膏比一般錫膏壽命提升約 50%-60%
當在錫鉍合金中增加第三種或第四種合金元素,執行溫度循環壽命試驗後,實驗結果顯示,壽命分析較錫-銀-銅合金提升約 50~60%(如下圖),這表示低溫錫膏對於環境類測試的影響較小。不過此結果是選擇較小的晶片進行測試,目的是比對各種錫膏之差異性,當選擇較大晶片來進行驗證時,壽命分布應該會更接近。
低溫錫膏不耐高溫,工作與應用環境溫度須審慎評估
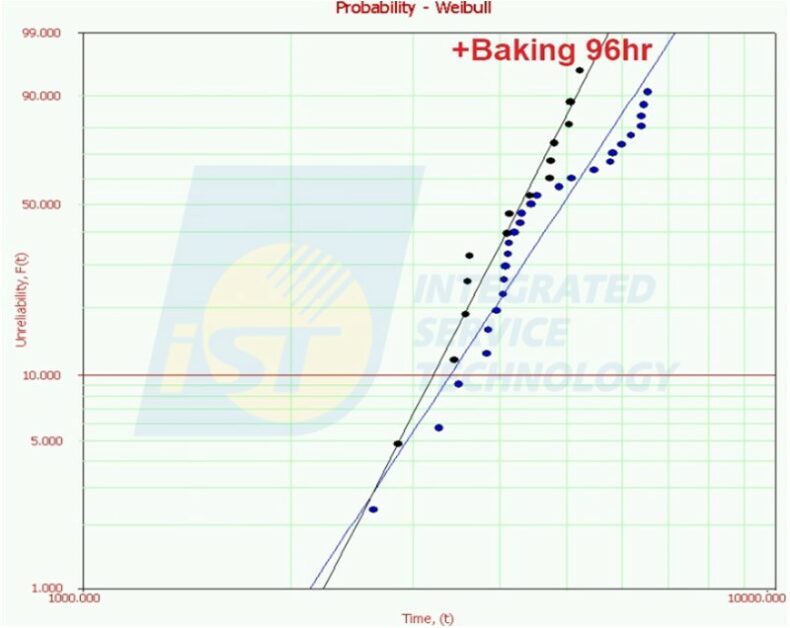
從溫度循環壽命試驗的實驗結果顯示低溫錫膏加入其他金屬,是有助於壽命提升的。但由於低溫錫膏的熔點溫度較低,材料再結晶溫度會趨近工作溫度與環境溫度,這會讓整體焊點結構還沒達到熔點溫度前,就會進行結構調整。根據下圖的驗證結果,進行溫度循環試驗前,我們針對低溫錫膏烘烤 96 小時,與未經烘烤比對後發現壽命下降約 15%。
這表示晶片或環境溫度達到 100oC 以上,焊點結構強度會逐漸下降,所以使用低溫錫膏時工作環境溫度與應用就須審慎評估,而不是每項產品都適合。
衝擊試驗(Shock Test)得知壽命特性之外,其他應力試驗也需考量
針對低溫錫膏應力問題,目前大廠規範多選擇衝擊測試(Shock Test)來驗證焊點強度,主要來自於衝擊測試會產生較大的應變力,因此可在短時間獲得壽命特性。不過除了衝擊測試外,產品在組裝過程中的負載強度、形變量、晶片承受壓力等,這些在低溫錫膏導入後,都必須考量進去,藉以確保可靠度品質能與現今製程有相同保障。
雖然低溫焊錫製程(LTS)在應用上,仍需要經過可靠度驗證等多方測試,才能確保產品結構與壽命。但面對減碳壓力及成本考量,宜特科技與德凱宜特實驗室分析認為,LTS 仍會成為未來主流趨勢。我們已布建完整低溫焊接製程驗證平台(LTS Platform),從測試機台、分析工具、板材與相關錫膏材料驗證等,可以大數據分析方式協助大廠進行材料開發,並針對市場需求建置更完整相關設備,提出更符合產品驗證流程。
此外,針對減碳議題,宜特亦提供碳水足跡盤查輔導與驗證服務,針對組織型溫室氣體與水足跡盤查 ISO 14064、碳足跡盤查 ISO 14067 以及溫室氣體節能 ISO 50001 等輔導服務。
本文出自 宜特科技。





















