人類的造訪可能直接或間接導致原生種野生動物的浩劫,這樣的故事在歷史發生過很多次了。大家最常聽到的故事應該會是老鼠跟著人到處跑,在上了某一個不幸的島嶼後,老鼠發現島上某種動物的蛋香甜營養又好偷,於是住下來把它們吃個精光。而這些動物從來沒看過老鼠,在還來不及發展出應變策略前就被滅種了。
現在,這樣的故事可能又要多加一些犧牲者了,地點是讓達爾文改變世界的加拉巴哥群島國家公園,而愛動物的無知觀光客將可能會變成幫兇。
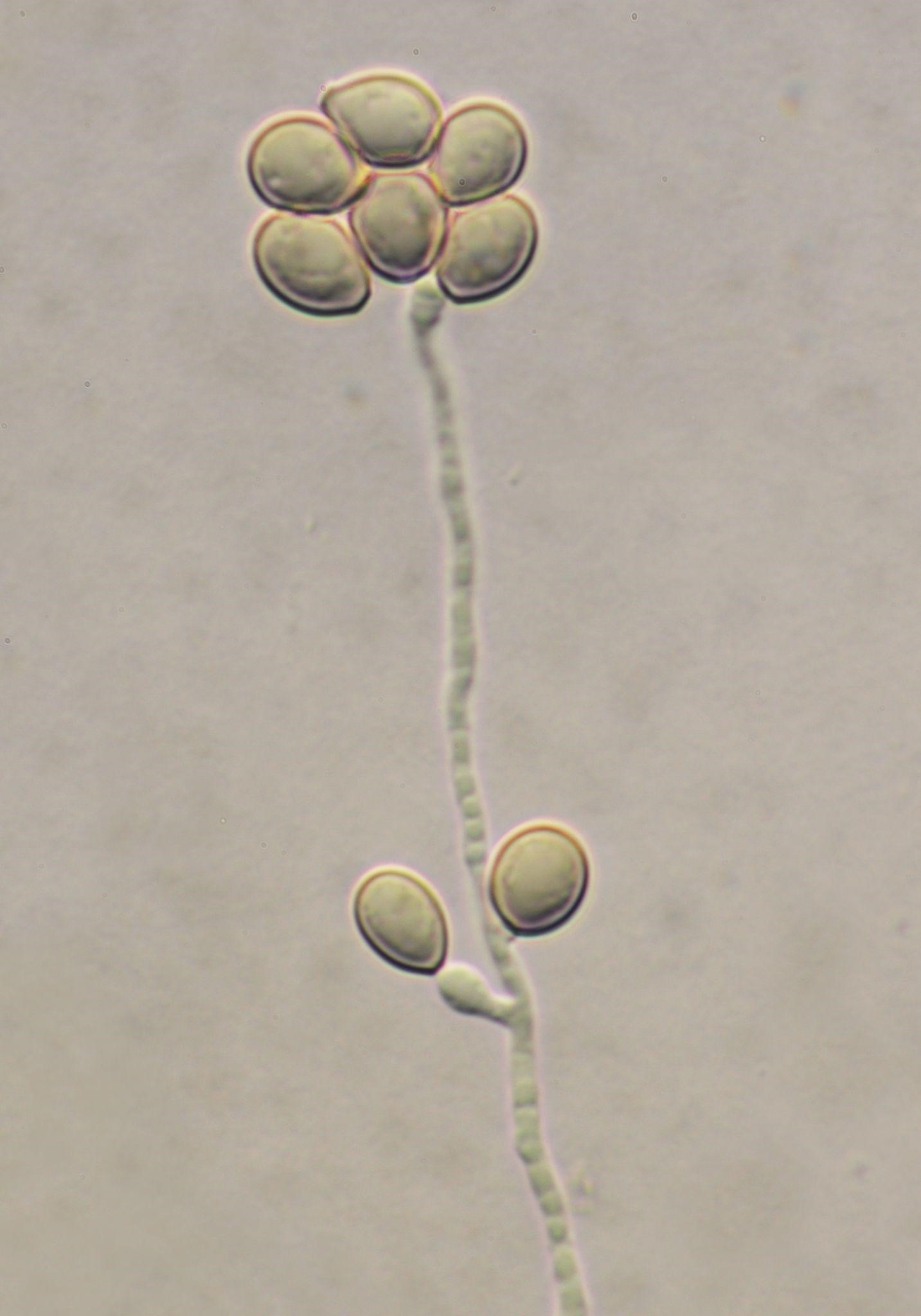
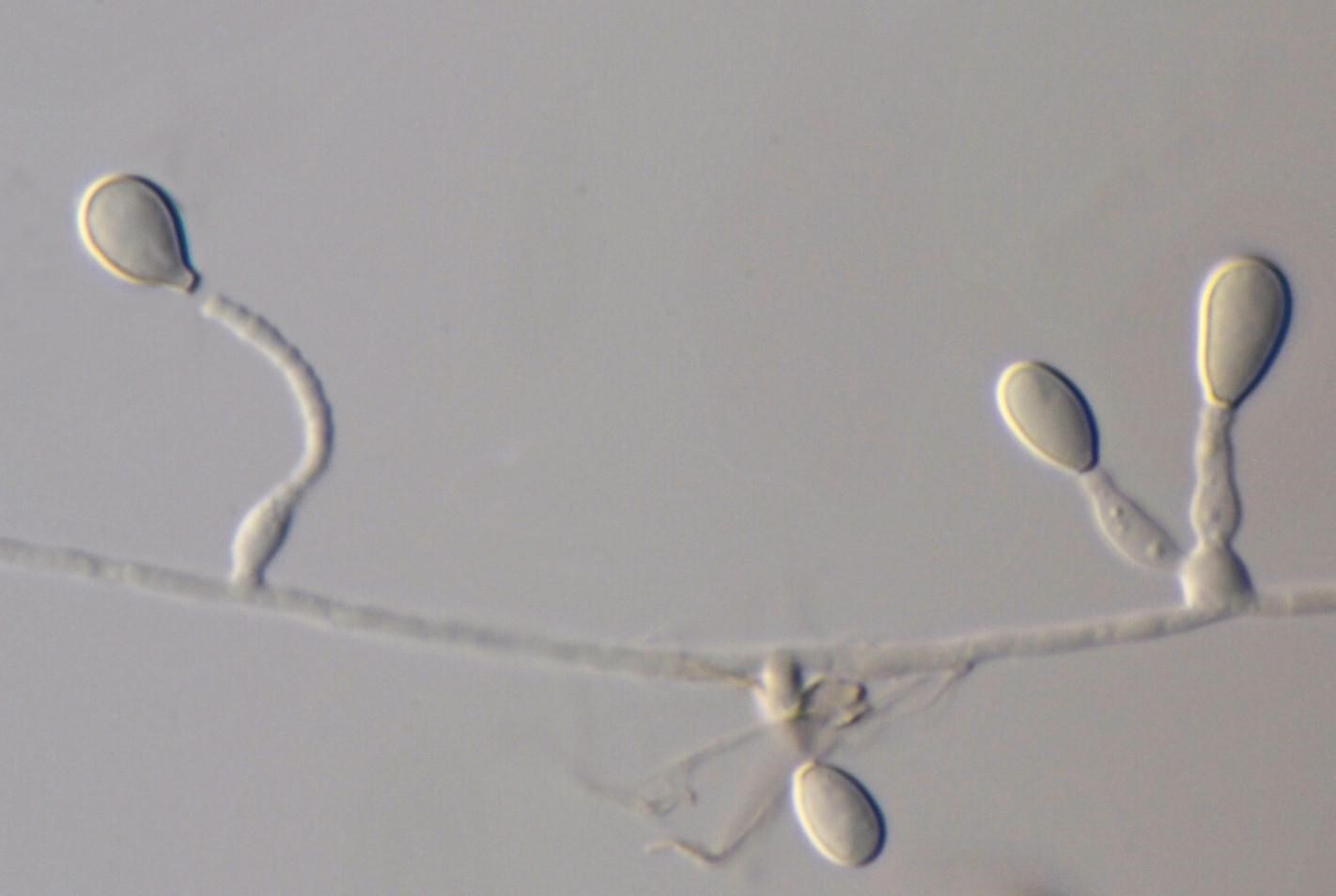
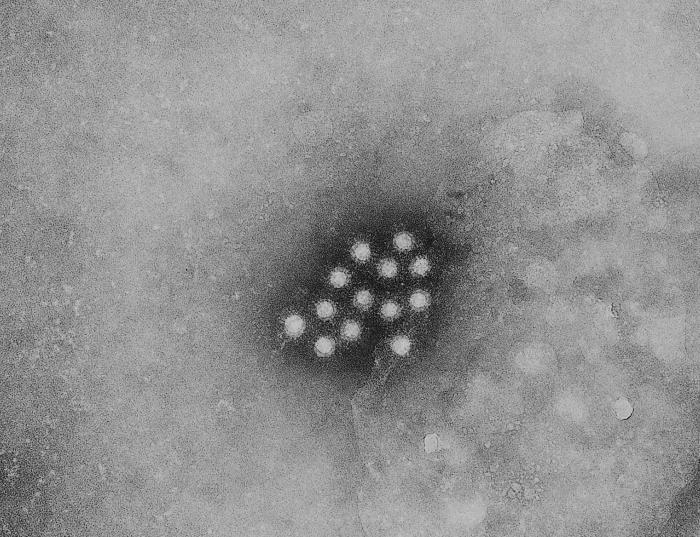
這個未來的兇嫌是熱帶家蚊(Culex quinquefasciatus),在臺灣也是個大家想除之而後快的病媒蚊。這份由里茲大學(University of Leeds)、倫敦動物學會(Zoological Society of London)、瓜亞基爾大學(University of Guayaquil) 、加拉巴哥國家公園(Galapagos National Park)及達爾文基金會(Charles Darwin Foundation)合作的研究報告指出,熱帶家蚊會利用搭觀光客便機的方式偷渡到島上,在島上散播病原使得野生動物死亡。研究人員可以估算有多少蚊子利用飛機來到島上,再經由比對蚊子的基因組成的相似度,可以推測出搭便機來到島上的蚊子裡有多少可以順利在島上活下來。遺傳分析還讓研究人員發現這些外來的蚊子會和當地蚊子通婚留下後代,而且也看得出蚊子的族群在群島的各島嶼間有旅行交流的跡象。當然,它們最有可能的旅行途徑又是搭上了觀光客的交通船及郵輪。
雖然這宗兇案還沒有發生,但是證據顯示現在已經是萬事俱備,只差某個病原菌或病毒跳上某隻蚊子偷渡成功,大滅絕可能就要發生了。熱帶家蚊已經被證實可以傳播原生動物造成的禽類瘧疾(avian malaria),以及病毒造成的禽類痘症(avian pox)及西尼羅河熱(West Nile fever)等足以讓鳥類致死的疾病。在19世紀末熱帶家蚊跟著人類的活動入侵夏威夷帶入了病厡,造成當地特有種的旋蜜雀(honeycreeper)們大量死亡,原本的 42 種旋蜜雀,現在活下來的只剩 19 種了。
建立國家公園原本是希望保住野生動物,然而現在又因為人的活動造成新的威脅,或許在國家公園的管理上,需要專家們多費心去設計一些防範措施,來阻斷這些可能造成危害的新途徑。
重要概念
- [普生] 瘧疾(malaria)是Plasmodium屬的瘧原蟲造成的疾病,分類上是原生動物門, 是單細胞的真核生物,寄生在紅血球裡。長太多會破壞太多紅血球造成貧血,引發的免疫反應也會造成發燒。
- [普生] 熱帶家蚊是昆蟲,屬於節肢動物門(Phylum Arthropoda)的昆蟲網(Insecta)。節肢動物的特徵是具有帶有關節的外骨骼附肢。
- [普生] 子代大部份的基因和親代一樣,所以可以從基因像不像這一點來判斷誰是誰的後代,做親子鑑定就是靠這一點。如果現在我面對三千隻紋子,只要分析某些基因的相似程度, 就可以看出從某隻没買機票的蚊子生下來的後代有多少。
- [生態] 很多入侵種生物都是藉由人類的活動被帶到自己没辦法獨力到達的地方。這種傳遞機制稱為 human-assisted dispersal。很多熟悉的生物是這樣來的,例如福壽螺,吳郭魚, 松材線蟲都是。
試試你的英文能力
- Disease-carrying Mosquitoes From Tourist Aircraft Threaten Galapagos Islands Wildlife
ScienceDaily (Aug. 12, 2009)
研究原文
- Bataille et al. 2009.
Evidence for regular ongoing introductions of mosquito disease vectors into the Galapagos Islands.
Proceedings of the Royal Society B: Biological Sciences; DOI: 10.1098/rspb.2009.0998