今天(2018/1/25)《細胞》期刊封面故事,兩隻複製猴「中中」、「華華」去年底在中國上海的中國科學院神經科學研究所,誕生啦!
這是首次使用體細胞核轉移技術(somatic cell nuclear transfer, SCNT)成功複製出的靈長類動物,這兩隻長尾獼猴(Macaca fascicularis)擁有完全一致的基因組,分別出生於 2017 年 11 月 27 日與 12 月 5 日。
體細胞核轉移技術的改良
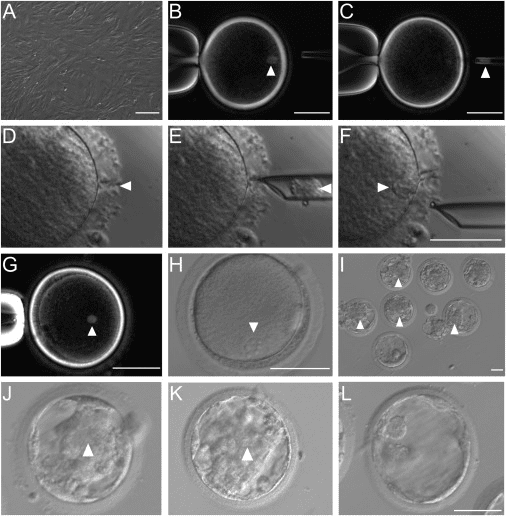
中中與華華其實並非首次被複製成功的靈長類動物:1999 年科學家也曾成功複製了普通獼猴,但使用的技術較接近於自然狀態下產生同卵雙胞胎的機制。在這次的研究中,科學家使用發展了二十多年的「體細胞核轉移」(somatic cell nuclear transfer, SCNT)技術,最出名的例子便是 1996 年出生的桃莉羊。科學家移除未受精的卵細胞之細胞核,再以另一個體細胞的細胞核取而代之;然後刺激該細胞發育為胚胎,再植入代理孕母的體內。
當初製造桃莉羊的科學團隊,在後續幾年也製造出了四隻相同的綿羊。體細胞核轉移技術在後續的研究中被應用在二十種不同的動物身上,包括青蛙、小鼠、大鼠、豬、牛甚至是狗。
「(這項技術)在非人類的靈長類物種上曾經嘗試過非常多次,但都失敗了。」論文共同作者、中科院上海神經科學研究所蒲慕明說。科學家長期認為猴子的基因有些因素讓此項技術無法成功,團隊本次的成功建立在很多實驗的改良上。
由中國科學院孫強研究員率領博士後研究員劉真為首的團隊調整了很多技術細節,從細胞核轉移到細胞融合內容。團隊花了三年完成這些調整,其中一個最主要的成功要素在於團隊使用了胚胎細胞核而非成體細胞核。其他調整內容還包括在胚胎早期階段注入經處理的 Kdm4d mRNA 並且使用組蛋白脫乙醯酶抑制劑(histone deacetylase inhibitor)trichostatin A 處理胚胎細胞,這些處理可以大幅增加懷孕的成功率。
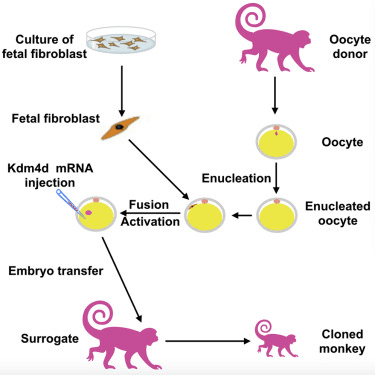
團隊在研究中分別使用了體細胞以及胚胎纖維母細胞(fetal fibroblast)的細胞核。但成功率還是有限的:來自體細胞的胚胎分別植入了 42 個代理孕母體內,22 例成功懷孕,有 2 隻出生但很快就夭折了;來自胚胎纖維母細胞的胚胎則植入了 21隻代理孕母體內,6 例成功懷孕,而成功出生的 2 隻小猴子就是「中中」和「華華」。
華華與中中目前分別為六週和八週大,由人工飼養長大,目前看起來發育生理上沒有任何問題。預計這幾個月將有更多小猴子出生。
「這兩隻小猴子非常活潑而且健康,他們就像人類的小孩一樣成長得很快。」論文通訊作者孫強說:「牠們看起來越長越活潑,而且沒有任何不正常。」
其他科學家怎麼看?
其他科學家表示有限的成功率代表了還需要更多的實驗,弗朗西斯 · 克里克研究所(Francis Crick Institute)胚胎發育與幹細胞研究部門的 Robin Lovell-Badge 說:「即使他們成功獲得了複製猴,但目前的數量太少,不足以達成任何結論,實驗效率仍然很低而不順利。」
「的確必須找到這(低生育率)相關的規則證據,」科羅拉多州立大學生生物醫學系助理教授 Jennifer Barfield 說,她從事的研究嘗試在美國野牛保育上做一樣的事情,她認為這項工作相當有趣且重要:「尤其是對於靈長類來說,成功並非隨手可得。」
「值得恭喜,我知道這件事有多難。」奧勒岡健康與科學大學的複製專家 Shoukhrat Mitalipov ,曾在 2000 年左右使用了超過 15,000 個猴子卵細胞嘗試進行複製,但沒能成功生出任何小猴子。
那麼,之後呢?
中國科學院神經科學研究所的團隊將會繼續優化體細胞核轉移的技術,並持續觀察中中與華華未來的生理與心理發育狀況。他們在發表的論文中表明希望他們的研究最終可以應用於了解人類疾病,如能加入現在的基因剪輯技術複製疾病的狀況等。希望能夠將複製猴應用於遺傳疾病的研究,如帕金森氏症、阿斯海默與亨丁氏症等。
「非人類的靈長類對於生醫領域的研究非常重要,」James Bourne ,澳洲蒙納許大學助理教授,國家健康與醫療研究顧問的資深成員說,「複製猴作為基因上與人類很相近的物種,可以成為醫學研究的重要工具。」
如果可以有效率提供擁有相同基因的實驗猴,預期將能應用於像是生醫、藥學領域。有些科學家認為能夠複製靈長類動物,對於研究人類疾病將有極大的幫助,在過去的實驗環境中,我們難以排除結果是由於實驗處理、或是個體的基因差異,而如果能使用複製動物進行醫學與藥理的實驗,便能更快速得到結果。
避免不了的倫理議題討論

這兩隻小複製猴的誕生也激起了相關的倫理爭論。人類也是靈長類的成員,科學家打破了複製靈長類的技術障礙,理論上也代表我們離複製人又更近了一步。論文的作者聲明他們無意複製人類,但他們也相信這項實驗會再度引出對於複製生物研究的規範討論。
英國肯特大學基因學的教授 Darren Griffin 說:「該是時候謹慎思考此類基因實驗『容許』及『應當』如何操作的倫理框架了。」他指出,將有批評湧出:「這項實驗結果將可以滑坡推演出我們距離複製人類又更近了一步。」但無論如何,Griffin 認為這項實驗的益處相當明確:「我個人對於此項研究的結果相當審慎樂觀,這是個非常令人印象深刻的技術突破。」
原始論文:
- Zhen Liu, Yijun Cai, Yan Wang, Yanhong Nie, et al. Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer. CELL, 2018.01.20
參考資料:
- Monkey see, monkey 2: Scientists clone monkeys using technique that created Dolly the sheep
- First monkeys cloned with technique that made Dolly the sheep
- These monkey twins are the first primate clones made by the method that developed Dolly
- 中國科學院神經科學研究所團隊突破體細胞克隆猴的世界難題