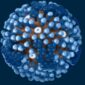
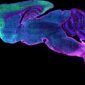
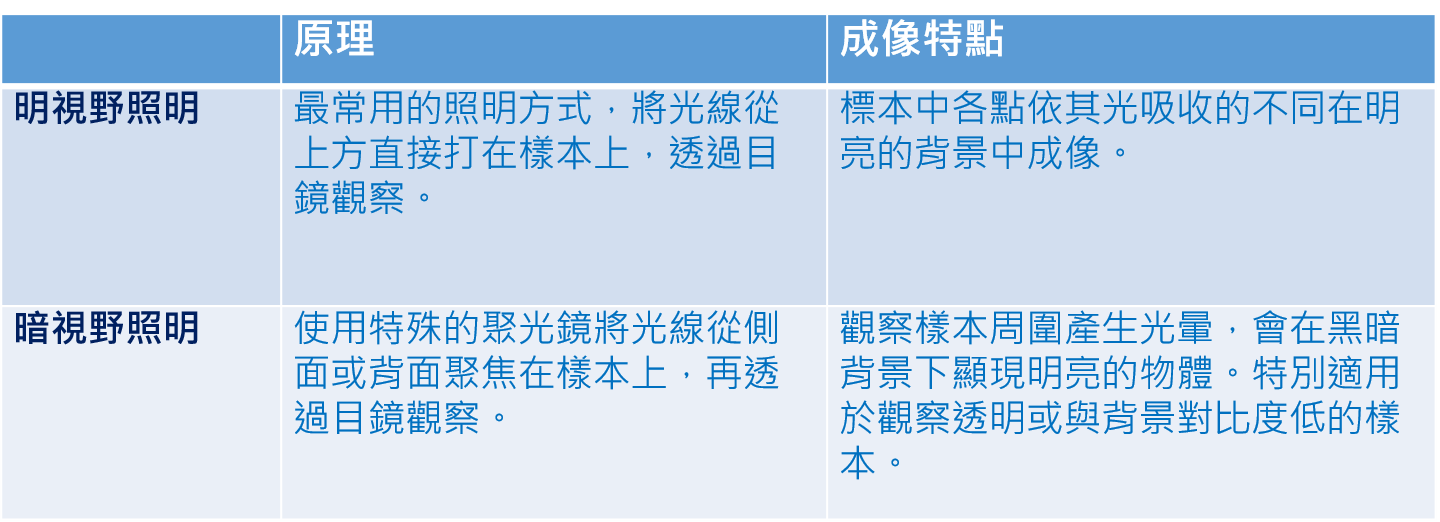
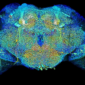
還記得去年清大江安世教授利用共軛焦顯微鏡建構出果蠅「腦內嗅覺神經網路地圖」,今天小編就簡易的寫一篇何謂雷射掃描共軛焦顯微鏡(Laser Scanning Confocal Microscopy ,簡稱LSCM)
雷射掃描共軛焦顯微鏡(Laser Scanning Confocal Microscopy ,簡稱LSCM)是近代生物醫學影像儀器的最重要發展之一,它是在螢光顯微雷射掃描裝置,使用紫外光或可見光激發螢光探針,利用電腦進行影像處理,從而得到細胞或組織內部微細結構的螢光影像,以及在亞細胞水平上觀察諸如Ca2+、pH值、膜電位等生理信號及細胞形態的變化。已廣泛應用於細胞生物學、生理學…,有時也被稱為雷射掃描細胞儀(Laser Scanning Cytometer,LSC)是八十年代迅速發展起來的用於分析細胞學的新型儀器。LSCM與普通光學顯微鏡相比優點明顯,分辨率、靈敏度、放大率和螢光檢測信噪比大大提高。對活細胞可以做分層掃描後,進行3D重建和測量分析,對細胞內微細結構的動態變化…
雷射掃描共軛焦顯微鏡的發展
科學研究工作對更高影像分辨率的追求產生了雷射掃描共軛焦顯微鏡。隨著免疫螢光技術在生物學研究領域的廣泛應用,研究人員注意到,螢光顯微顯微鏡使用場光源,因標本鄰近結構(細胞或亞細胞結構)產生的衍射光和散射光的干擾,使標本中細微結構的成像不夠清晰。
一. 組成
倒置或正立螢光顯微鏡、掃描頭(照明針孔、探測針孔、螢光濾片系統、鏡掃描系統和光電倍增管)、掃描頭控制電路、電腦和影像輸出設備
二. 原理
利用放置在光源後的照明針孔和放置在檢測器前的探測針孔實現點照明和點探測,來自光源的光通過照明針孔發射出的光聚焦在樣品焦平面的某個點上,該點所發射的螢光成像在探測針孔上,該點以外的任何發射光均被探測針孔阻擋。照明針孔與探測針孔對被照射點或被探測點來說是共軛的,因此被探測點即共焦點,被探測點所在的平面即共焦平面。電腦以像點的方式將被探測點顯示在電腦螢幕上,為了產生一幅完整的影像,由光路中的掃描系統在樣品焦平面上掃描,從而產生一幅完整的共焦影像。只要載物台沿著Z軸上下移動,將樣品新的一個層面移動到共焦平面上,樣品的新層面又成像在顯示器上,隨著Z軸的不斷移動,就可得到樣品不同層面連續的光切影像。
在共軛焦顯微鏡的價格都是幾百萬台幣以上,因為非常精密所以價格不斐。
前一陣子工研院光電所已經有做出一台簡易式的共軛焦顯微鏡,小編已經測試過囉!當然精密度無法像正常一樣,但用來教學或用於較大型的物體還可堪用,售價小編記得大約在五十萬左右吧!
原文出處:Photomicrography can also be an art!