- 作者 / 李姿涵
2015 台北醫學大學藥學系畢業
2015- 台灣大學藥理學研究所 碩士班直升博士班
你是否覺得自己經常忘東忘西,記憶力越來越差,甚至被朋友開玩笑說「你是失智喔」?不過別以為這只是開玩笑,失智症患者的確存在於你我生活中,而且比例越來越多。如果有一天,自己真的得到失智症該怎麼辦?目前有沒有藥物可以治療?到底藥物發展遇到什麼困境?我們又該如何面對?

目前的失智症藥物只能延緩病程,無法治癒疾病
隨著高齡化社會的來臨,失智症議題逐漸被廣泛討論。失智症人口的增加不僅發生在台灣,在全世界的盛行率也越來越高 [1-3]。而失智症的諸多種類中,最常見且最被廣泛研究的是阿茲海默症(Alzheimer’s disease),目前治療方式主要使用藥物改善臨床症狀,延緩認知功能退化,藥物主要有膽鹼酶抑制劑(cholinesterase inhibitors) 以及 NMDA 受體拮抗劑(NMDA receptor antagonists)[4]。
然而,現有的藥物只能延緩病程,而且臨床效果似乎不是很好 [5、6],也無法治癒疾病。此外,自從2003年 NMDA 受體拮抗劑(Memantine) 通過美國食品藥物管理署(FDA)上市到今天,這十多年的時間竟然都沒有出現新的藥物。為什麼阿茲海默症的藥物需求如此急切,開發的速度卻如此緩慢呢?是不是遇上了什麼難以突破的瓶頸?
「澱粉樣蛋白」就是阿茲海默症的兇手?
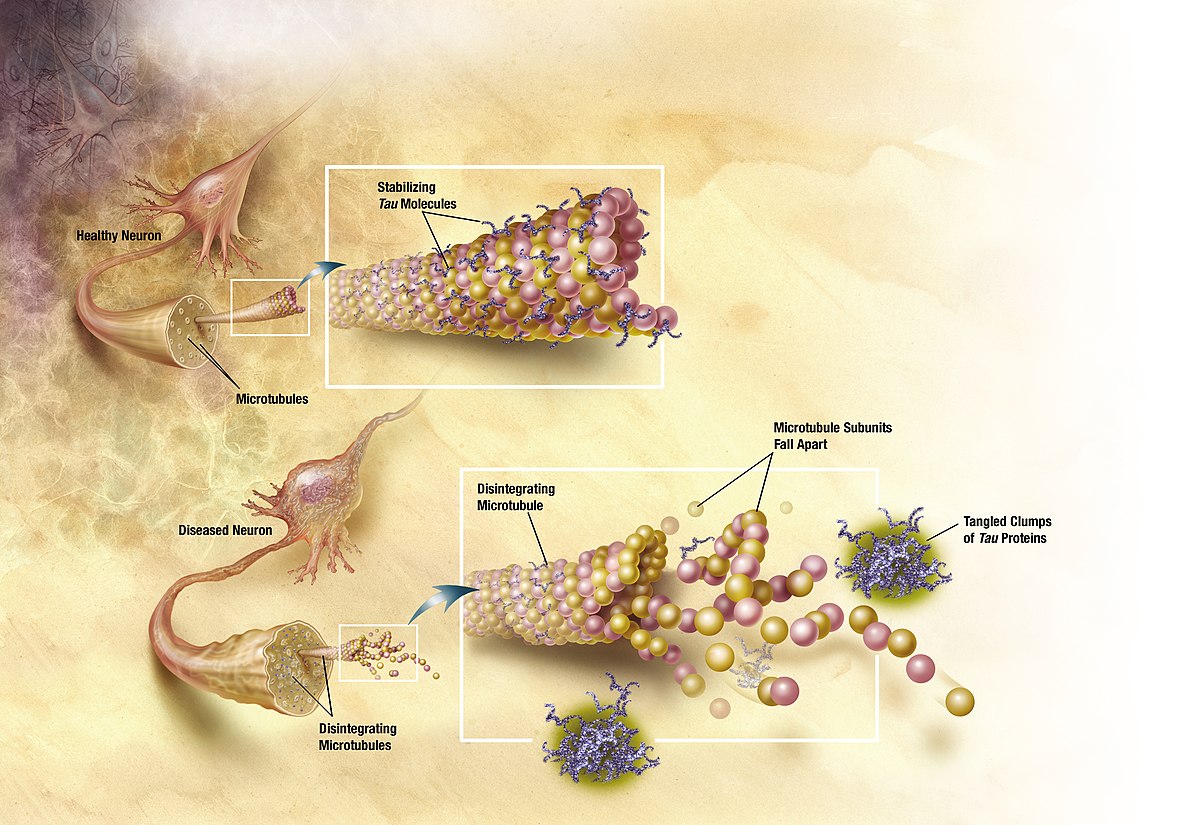
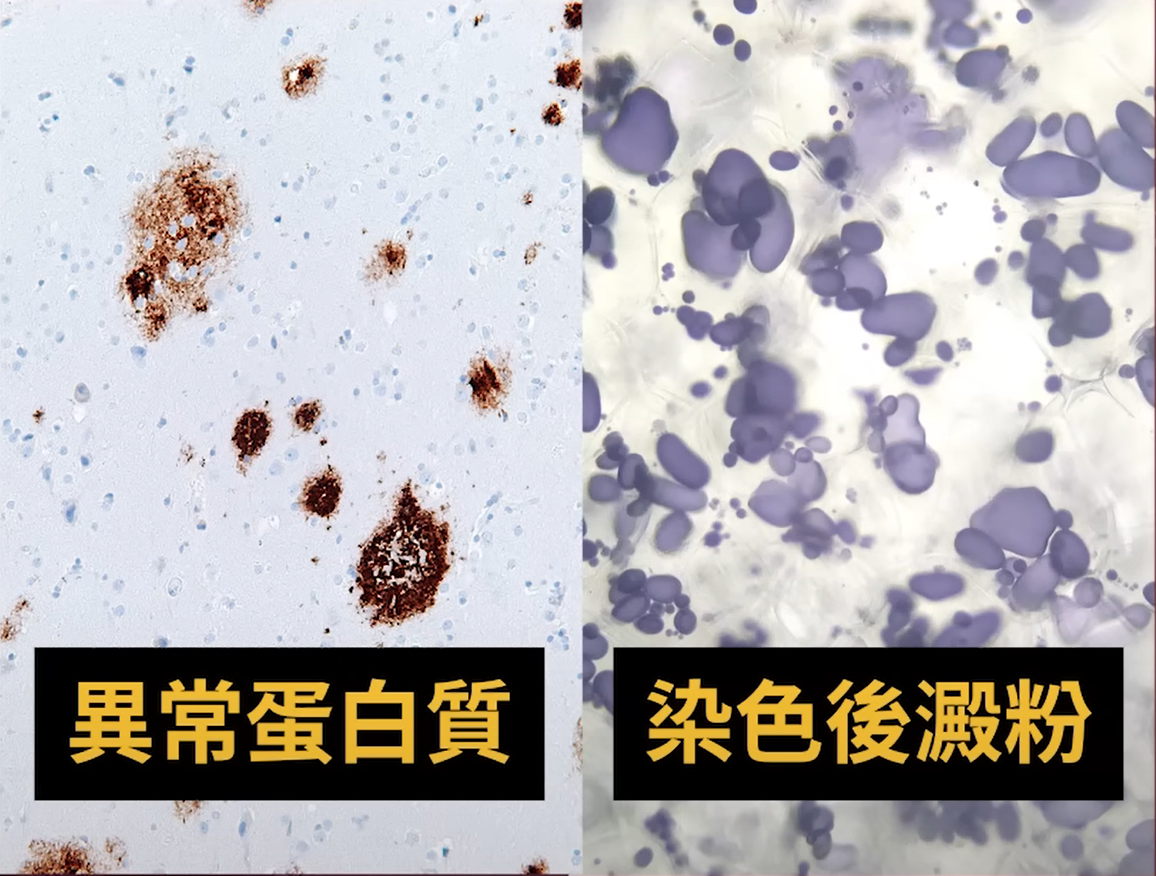
有鑑於先前藥物效果有限,越來越多科學家開始從了解疾病根本原因著手研究,希望藉由調節疾病病程,以延緩臨床上認知功能障礙或甚至促進認知功能。阿茲海默症的病因目前被認為和大腦中β澱粉樣蛋白(β-amyloid)的過度堆積影響神經間的聯繫,甚至造成神經細胞死亡有關 [7-11]。因此,藥物研發大多根基於澱粉樣蛋白假說 (amyloid hypothesis),針對如何減少澱粉樣蛋白的產生,或清除澱粉樣蛋白的堆積。
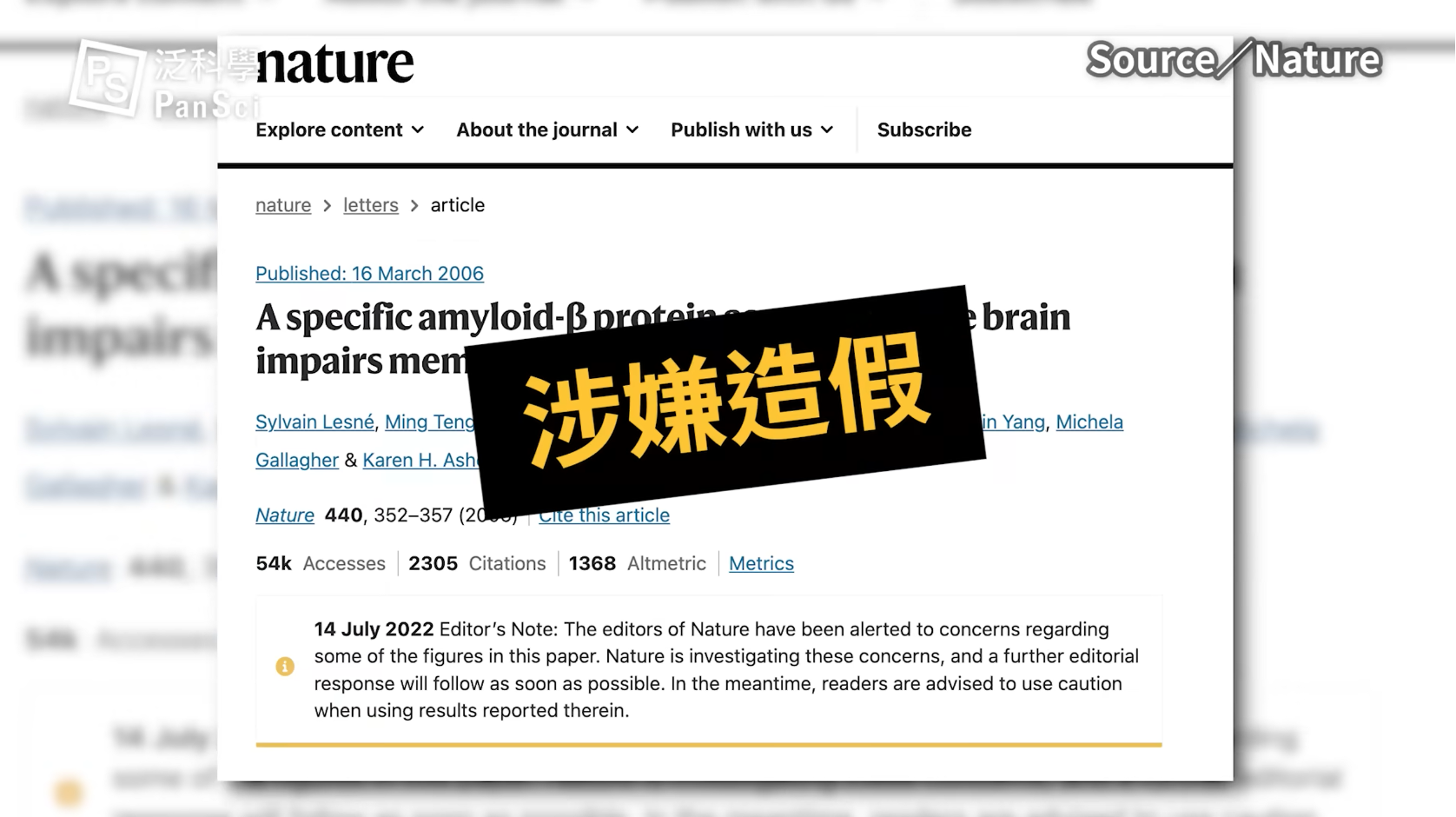
近十多年來,科學家研發出抑制澱粉樣蛋白產生的 γ-secretase inhibitors,以及將澱粉樣蛋白清除的單株抗體 (anti-amyloid antibodies)。但這些藥物雖然在動物實驗及臨床試驗一、二期有些不錯的成果 [12-17],卻在第三期臨床試驗中相繼宣告失敗。有的是因為副作用太大而終止試驗 [18],有的即使能減少澱粉樣蛋白堆積,卻無法顯著改善病人的認知功能 [19,20]。在接二連三的挫敗後,科學家們努力檢討到底哪個環節出了問題。與此同時,有越來越多聲音指向源頭:會不會是一開始澱粉樣蛋白假說就出了問題?
澱粉樣蛋白假說經得起科學考驗嗎?
澱粉樣蛋白假說建立至今已 25 年之久 [21,22],雖然目前還沒被證明,卻也沒有足夠證據推翻。面對這個具有許多爭議性的假說,科學家仍努力用各種實驗數據去支持、修改、提出疑問 [23],目的就是為了更瞭解阿茲海默症真正的原因,才能開發出關鍵性的治療藥物。
此外,雖然前述的藥物臨床試驗失敗了,但也不代表澱粉樣蛋白假說是錯的,這些抗體也不是毫無價值 [24]。科學家指出:早在病人出現阿茲海默症臨床症狀前的十幾年,他們的腦部就已經有澱粉樣蛋白的堆積 [4],因此,許多專家認為這些抗體治療的對象應該要更提前到臨床症狀還沒出現的病人(asymptomatic patients)[24, 25],這似乎又讓抗體治療燃起一絲希望。目前至少有五個預防試驗(prevention trials),針對臨床症狀還沒出現但經過其他方式診斷為阿茲海默症的病人,或是高風險族群來做試驗 [24],不論結果是什麼,都可以更進一步確認澱粉樣蛋白及抗體在阿茲海默中的角色。
基礎研究的科學家又是如何看待臨床試驗的失敗?
基礎研究和臨床研究的關係密不可分,臨床試驗的失敗對於基礎研究人員來說也是一大挫折。一個新藥研發到上市,通常要經過臨床前的細胞、動物實驗,再進入臨床試驗三期,才有機會獲得 FDA 核准上市 [26]。為什麼在臨床前實驗看似有效,到臨床試驗卻一一陣亡了呢?原因其中之一可能是老鼠實驗取得的成功模式,可能無法完全套用到人體內的實際情形。從基礎到臨床中間其實一直存在很大的鴻溝,許多專家認為基礎研究多使用的老鼠模型,並無法從其中推斷人類的情況。

那麼接下來的路要怎麼走?
看到這裡是否覺得萬一得病就要世界末日了 [註1]?千萬別灰心呀!科學家在疾病模型方面投入許多心力且已經有些突破囉!
以阿茲海默症模型來說,二十年前科學家就已經以基因轉殖鼠模擬發病狀況 [27];到了近幾年幹細胞研究盛行,出現了將人類的細胞做成誘導性多功能幹細胞 (iPSC)、再分化成神經細胞的模型 [28,29],從這樣的模型的確發現有些病理現象和以往動物模型有些不同,而且和病人更接近。當將人類基因角色考慮至其中,可以藉此更了解疾病分子層面的機轉 [30],像是正常人與病人間有哪些基因表現不同?了解這些基因是如何被調控?和澱粉樣蛋白之間又存在什麼關係?期望能一步步揭開澱粉樣蛋白的神秘面紗。當研究模型越接近真實人體的情況時,或許可以縮小基礎到臨床研究的間隙。
聽起來或許有點八股,但這就是做研究吸引人的地方呀!即使困難重重,總是有預料之外的驚喜,好的、壞的,都將成為下一個研究中重要的養分。阿茲海默藥物開發是條漫長未知的路,但在這條道路上的夥伴們,無論是實驗室基礎研究的科學家、到醫院藥廠臨床實驗設計的研究人員,都有希望為人類改善些什麼的熱血與使命感。哪怕畢生的研究只是科學史上的一小步,大家堅信總有戰勝疾病的那一天。
- [註1]:這篇主要討論藥物研發困境,對於疾病照護有相關疑問可以參考台灣失智症協會網站。
參考文獻
- 國際失智症協會(Alzheimer’s Disease International)
- 美國阿茲海默症協會(Alzheimer’s Association)
- 台灣失智症協會
- Masters, C.L., et al., Alzheimer’s disease. Nat Rev Dis Primers, 2015. 1: p. 15056.
- Takeda, A., et al., A systematic review of the clinical effectiveness of donepezil, rivastigmine and galantamine on cognition, quality of life and adverse events in Alzheimer’s disease. Int J Geriatr Psychiatry, 2006. 21(1): p. 17-28.
- Di Santo, S.G., et al., A meta-analysis of the efficacy of donepezil, rivastigmine, galantamine, and memantine in relation to severity of Alzheimer’s disease. J Alzheimers Dis, 2013. 35(2): p. 349-61.
- Hardy, J. and D.J. Selkoe, The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. Science, 2002. 297(5580): p. 353-6.
- Tanzi, R.E. and L. Bertram, Twenty years of the Alzheimer’s disease amyloid hypothesis: a genetic perspective. Cell, 2005. 120(4): p. 545-55.
- Haass, C. and D.J. Selkoe, Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer’s amyloid beta-peptide. Nat Rev Mol Cell Biol, 2007. 8(2): p. 101-12.
- Beyreuther, K. and C.L. Masters, Amyloid precursor protein (APP) and beta A4 amyloid in the etiology of Alzheimer’s disease: precursor-product relationships in the derangement of neuronal function. Brain Pathol, 1991. 1(4): p. 241-51.
- Hardy, J.A. and G.A. Higgins, Alzheimer’s disease: the amyloid cascade hypothesis. Science, 1992. 256(5054): p. 184-5.
- Henley, D.B., et al., Development of semagacestat (LY450139), a functional gamma-secretase inhibitor, for the treatment of Alzheimer’s disease. Expert Opin Pharmacother, 2009. 10(10): p. 1657-64.
- Panza, F., et al., Bapineuzumab: anti-beta-amyloid monoclonal antibodies for the treatment of Alzheimer’s disease. Immunotherapy, 2010. 2(6): p. 767-82.
- Ostrowitzki, S., et al., Mechanism of amyloid removal in patients with Alzheimer disease treated with gantenerumab. Arch Neurol, 2012. 69(2): p. 198-207.
- Panza, F., et al., Efficacy and safety studies of gantenerumab in patients with Alzheimer’s disease. Expert Rev Neurother, 2014. 14(9): p. 973-86.
- Imbimbo, B.P., et al., Solanezumab for the treatment of mild-to-moderate Alzheimer’s disease. Expert Rev Clin Immunol, 2012. 8(2): p. 135-49.
- Sevigny, J., et al., The antibody aducanumab reduces Abeta plaques in Alzheimer’s disease. Nature, 2016. 537(7618): p. 50-6.
- Doody, R.S., et al., A phase 3 trial of semagacestat for treatment of Alzheimer’s disease. N Engl J Med, 2013. 369(4): p. 341-50.
- Salloway, S., et al., Two phase 3 trials of bapineuzumab in mild-to-moderate Alzheimer’s disease. N Engl J Med, 2014. 370(4): p. 322-33.
- Doody, R.S., et al., Phase 3 trials of solanezumab for mild-to-moderate Alzheimer’s disease. N Engl J Med, 2014. 370(4): p. 311-21.
- Karran, E., M. Mercken, and B. De Strooper, The amyloid cascade hypothesis for Alzheimer’s disease: an appraisal for the development of therapeutics. Nat Rev Drug Discov, 2011. 10(9): p. 698-712.
- Selkoe, D.J. and J. Hardy, The amyloid hypothesis of Alzheimer’s disease at 25 years. EMBO Mol Med, 2016. 8(6): p. 595-608.
- Selkoe, D.J., Resolving controversies on the path to Alzheimer’s therapeutics. Nat Med, 2011. 17(9): p. 1060-5.
- Mullard, A., Alzheimer amyloid hypothesis lives on. Nat Rev Drug Discov, 2016. 16(1): p. 3-5.
- Gandy, S. and M. Sano, Alzheimer disease: Solanezumab-prospects for meaningful interventions in AD? Nat Rev Neurol, 2015. 11(12): p. 669-70.
- Dickson, M. and J.P. Gagnon, Key factors in the rising cost of new drug discovery and development. Nat Rev Drug Discov, 2004. 3(5): p. 417-29.
- Hall, A.M. and E.D. Roberson, Mouse models of Alzheimer’s disease. Brain Res Bull, 2012. 88(1): p. 3-12.
- Choi, S.H., et al., A three-dimensional human neural cell culture model of Alzheimer’s disease. Nature, 2014. 515(7526): p. 274-8.
- Espuny-Camacho, I., et al., Hallmarks of Alzheimer’s Disease in Stem-Cell-Derived Human Neurons Transplanted into Mouse Brain. Neuron, 2017. 93(5): p. 1066-1081 e8.
- Wood, H., Alzheimer disease: A novel human-mouse chimaeric model of Alzheimer disease. Nat Rev Neurol, 2017. 13(4): p. 193.