阿茲海默症是最常見的失智症。根據預估全球超過三千五百萬人口患有阿茲海默症,到了 2030 年患病人口可能會來到六千六百萬。台灣衛生署委託台灣失智症協會進行民國 100 年 1 月至 100 年 12 月的全國失智症盛行率調查,指出台灣 65 歲以上長者的失智症盛行率為 4.97% [01、02]。
「呆子,別再抽菸了!小心肺癌啊!」每次回到家總是聽到媽媽對著老爸這樣吼。全球約有二十億的吸菸人口,而吸菸造成的相關疾病造成至少每年四百萬人死亡。和吸菸相關的疾病包含心血管疾病、慢性阻塞性肺病、中風、癌症與神經認知異常[03]。
我不禁想問,抽菸和阿茲海默症,有關嗎?
阿茲海默症是一個漫長的過程,在失智症特徵顯現前,會有長達數十年的無徵狀臨床前階段。在臨床前階段,隨著時間的流逝,慢慢會出現輕度認知障礙與記憶受損。儘管許多科學家努力想解開阿茲海默症的機轉謎團,但目前最確切的機轉還是無人可解[04]。
你或許聽過阿茲海默症可能的形成機轉,但是目前都僅限於假說。兩個阿茲海默症最主要的神經病理特徵為類澱粉蛋白斑塊與細胞內神經糾結。
類澱粉蛋白斑塊的形成是因為不可溶性的乙型-類澱粉蛋白(amyloid beta)聚集。神經糾結主要是因為細胞內過度磷酸化的 tau 蛋白聚集。根據目前阿茲海默症發展的最主要「假說」, 乙型-類澱粉蛋白造成斑塊的形成,會伴隨著廣泛性的皮層 tau 過度磷酸化現象、炎症、突觸降解和神經元損失[05]。
雖然阿茲海默症的機轉尚未完全明確,但是可以確定年紀為其中一個重要的危險因子。而老化可能和其他潛在危險因子會有交互作用,增加阿茲海默症的風險。
例如吸菸,可能就是一個危險因子。越來越多的病理學證據顯示抽菸與阿茲海默症的風險增高有關係[06、07、08]。和從未吸菸者比較,十七到二十一歲的的吸煙者在注意力、學習、記憶力、衝動控制的表現均較差。25到60歲的吸菸者亦然。65歲以上的吸菸者,除了神經認知的表現較差,可觀察到大腦萎縮的情況。那是什麼原因使吸菸和阿茲海默症有關呢?[03]
氧化壓力,指的是大腦或組織因為氧化劑造成的傷害。
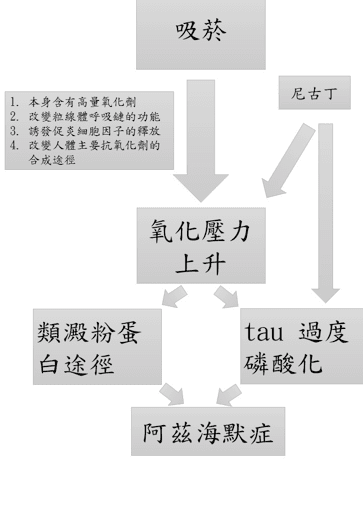
比較吸菸者與未吸菸者的屍體 (87±6 歲),發現吸菸者的神經元脂質過氧化作用明顯較高。香菸成分複雜,包含尼古丁等其他具有細胞毒性或致癌性的成分;香菸的氣體也具有高濃度的氧化劑。此外抽菸會改變粒線體呼吸鏈的功能、誘發促炎細胞因子的釋放、改變人體主要抗氧化劑穀胱甘肽的合成途徑,並降低其產量。這些因素會造成顱內氧化壓力,可能為乙型-類澱粉蛋白和 tau 病理產生的基礎機轉,進一步造成阿茲海默症[09~15]。
那香菸裡面很重要的成分,尼古丁呢?他扮演了什麼樣的角色?
動物實驗中,慢性的尼古丁供給會降低皮層與海馬迴的斑塊與不溶性乙型-類澱粉蛋白1-40 與乙型-類澱粉蛋白1-42的量。但是不會改變可溶性乙型-類澱粉蛋白1-40 與乙型-類澱粉蛋白1-42 。人體內是可溶性乙型-類澱粉蛋白和認知異常有關。因此尼古丁可能和乙型-類澱粉蛋白路徑較無關聯。細胞實驗中,尼古丁會增加過度磷酸化tau以及總tau量。動物實驗中,尼古丁會增加海馬迴內的tau聚集和磷酸化。因此尼古丁影響的可能是tau 路徑。[16~19]
我們可以用下圖簡單做一個總結,吸菸導致氧化壓力的產生,氧化壓力是造成阿茲海默的開端。香菸中的成分尼古丁,則是能藉由增加氧化壓力,或是直接對 tau 蛋白途徑造成影響。
參考資料:
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., & Ferri, C. P. (2013). The global prevalence of dementia: a systematic review and metaanalysis.Alzheimer’s & Dementia,9(1), 63-75.
- 邱銘章、陳達夫、王培寧、白明奇、黃正平及花茂棽。2013。失智症(含輕度認知功能障礙 (mild cognitive impairment, MCI))流行病學調查及失智症照護研究計畫。台北。
- Durazzo, T. C., Meyerhoff, D. J., & Nixon, S. J. (2010). Chronic cigarette smoking: implications for neurocognition and brain neurobiology.International journal of environmental research and public health,7(10), 3760-3791.
- Sperling, R. A., Aisen, P. S., Beckett, L. A., Bennett, D. A., Craft, S., Fagan, A. M., … & Phelps, C. H. (2011). Toward defining the preclinical stages of Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease.Alzheimer’s & Dementia,7(3), 280-292.
- Nelson, P. T., Alafuzoff, I., Bigio, E. H., Bouras, C., Braak, H., Cairns, N. J., … & Beach, T. G. (2012). Correlation of Alzheimer disease neuropathologic changes with cognitive status: a review of the literature.Journal of neuropathology and experimental neurology,71(5), 362.
- Alzheimer’s Association. (2012). 2012 Alzheimer’s disease facts and figures.Alzheimer’s & Dementia,8(2), 131-168.
- Barnes, D. E., & Yaffe, K. (2011). The projected effect of risk factor reduction on Alzheimer’s disease prevalence.The Lancet Neurology,10(9), 819-828.
- Cataldo, J. K., Prochaska, J. J., & Glantz, S. A. (2010). Cigarette smoking is a risk factor for Alzheimer’s Disease: an analysis controlling for tobacco industry affiliation.Journal of Alzheimer’s Disease,19(2), 465-480.
- Seet, R. C., Lee, C. Y. J., Loke, W. M., Huang, S. H., Huang, H., Looi, W. F., … & Halliwell, B. (2011). Biomarkers of oxidative damage in cigarette smokers: which biomarkers might reflect acute versus chronic oxidative stress?.Free Radical Biology and Medicine,50(12), 1787-1793.
- Sonnen, J. A., Larson, E. B., Gray, S. L., Wilson, A., Kohama, S. G., Crane, P. K., … & Montine, T. J. (2009). Free radical damage to cerebral cortex in Alzheimer’s disease, microvascular brain injury, and smoking.Annals of neurology,65(2), 226-229.
- Talhout, R., Schulz, T., Florek, E., Van Benthem, J., Wester, P., & Opperhuizen, A. (2011). Hazardous compounds in tobacco smoke.International journal of environmental research and public health,8(2), 613-628.
- Ambrose, J. A., & Barua, R. S. (2004). The pathophysiology of cigarette smoking and cardiovascular disease: an update.Journal of the American College of Cardiology,43(10), 1731-1737.
- Alonso, J. R., Cardellach, F., Casademont, J., & Miro, O. (2004). Reversible inhibition of mitochondrial complex IV activity in PBMC following acute smoking.European Respiratory Journal,23(2), 214-218.
- Mazzone, P., Tierney, W., Hossain, M., Puvenna, V., Janigro, D., & Cucullo, L. (2010). Pathophysiological impact of cigarette smoke exposure on the cerebrovascular system with a focus on the blood-brain barrier: expanding the awareness of smoking toxicity in an underappreciated area.International journal of environmental research and public health,7(12), 4111-4126.
- Bloomer, R. J. (2007). Decreased blood antioxidant capacity and increased lipid peroxidation in young cigarette smokers compared to nonsmokers: impact of dietary intake.Nutrition journal,6(1), 39.
- Butterfield, D. A., Swomley, A. M., & Sultana, R. (2013). Amyloid β-peptide (1–42)-induced oxidative stress in Alzheimer disease: importance in disease pathogenesis and progression.Antioxidants & redox signaling,19(8), 823-835.
- Durazzo, T. C., Mattsson, N., Weiner, M. W., & Alzheimer’s Disease Neuroimaging Initiative. (2014). Smoking and increased Alzheimer’s disease risk: a review of potential mechanisms.Alzheimer’s & Dementia,10(3), S122-S145.
- Hellström‐Lindahl, E., Moore, H., & Nordberg, A. (2000). Increased Levels of Tau Protein in SH‐SY5Y Cells After Treatment with Cholinesterase Inhibitors and Nicotinic Agonists.Journal of neurochemistry,74(2), 777-784.
- Oddo, S., Caccamo, A., Green, K. N., Liang, K., Tran, L., Chen, Y., … & LaFerla, F. M. (2005). Chronic nicotine administration exacerbates tau pathology in a transgenic model of Alzheimer’s disease.Proceedings of the National Academy of Sciences of the United States of America,102(8), 3046-3051.