本文轉載自PEREGRINE科學點滴
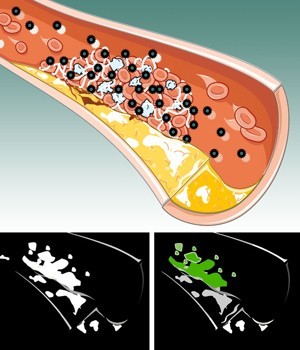
近20年來,心臟病學家們已搜尋了多種在引發心臟病發作前,發現可能造成傷害之血液凝塊的方法。
目前,美國密蘇里州聖路易斯市華盛頓大學醫學院(Washington University School of Medicine in St. Louis)的研究人員們報告,他們已設計出找尋血液凝塊,並使其在新型X-射線技術下可見的奈米粒子。
根據巴恩斯猶太醫院(Barnes-Jewish Hospital:美國華盛頓大學醫學院附設教學醫院)心臟病學家Gregory Lanza博士的說法,此些奈米粒子能免除,在認定因胸痛來到醫院之病患是否實際罹患心臟發作上的揣測。
身為內科學教授的Lanza宣稱:「每年,有數百萬人因胸痛來到急診室。醫師們知道,其中一些病患不是因為他們的心臟。不過其中多數,醫師們並不確定。」當有任何疑惑時,病患必需住院並接受檢查,以排除或證實心臟病發作。而那些檢查既花錢且費時。
無需過夜來確保病患是穩定的,該項新技術能在數小時之內揭露血液凝塊的位置。
此些奈米粒子旨在與有能力發現金屬色彩的新型電腦斷層掃瞄儀(CT scanner)一起使用。該被稱為光譜電腦斷層掃瞄(spectral CT)的新技術,使用X-射線束的全光譜來區別,使用僅看見黑與白之普通電腦斷層掃瞄儀,難以分辨的物體。
Lanza表示,該種新掃瞄儀利用了,天文學家們用來探索出自恆星的光及辨別恆星含有什麼金屬的相同物理特性。
Lanza宣稱:「他們正進行X-射線光譜(X-ray spectrum)的探索,而X-射線光譜能告知他們存在什麼金屬。那正是他們所想要的。」
在此情況下,正被討論的金屬是鉍(bismuth)。內科學的研究助理教授Dipanjan Pan博士設計了一種,含鉍量足以被光譜電腦斷層掃瞄儀發現的奈米粒子。
Lanza宣稱:「每一奈米粒子含有百萬個鉍原子。」由於電腦斷層掃瞄是種相對上不敏銳的造影技術,因而十足的金屬數量是此些粒子能被該種掃瞄儀發現所必需的。
不過Pan表示,鉍是種有毒的重金屬,不能單獨被注入人體中。因而,Pan使用了一種由鉍原子附著於脂肪酸鏈所形成,而在人體中不會分離的混合物。之後,將該種混合物封裝於磷脂膜(phospholipid membrane)中。
於老鼠的模型體中,證實此些奈米粒子的設計,能於體內破裂開並以安全的方式釋出內部的鉍混合物。
一旦此些奈米粒子含鉍量足以被光譜電腦斷層掃瞄儀發現時,Pan於此些粒子表面添加了一種能找尋出被稱為血纖維(fibrin)之蛋白質的分子。血纖維是血液凝塊中常見的一種蛋白質,不過於脈管系統中的其他地方未被發現。
Lanza宣稱:「當心臟病發作時,冠狀動脈的襯裡已破裂,因而會形成凝塊來加以修補。不過這種凝塊開始縮窄血管,因而血液逐漸無法通過。目前,他們擁有了能發現那種凝塊的奈米粒子。」
藉由鎖定血纖維之鉍奈米粒子的光譜電腦斷層掃瞄影像,能提供傳統電腦斷層掃瞄之黑與白影像的相同資訊。不過,於任何血液凝塊中的血纖維,會以諸如黃或綠的色彩呈現出。這解決了,於傳統電腦斷層掃瞄儀中常見的鈣干擾問題。
於該項研究中使用的光譜電腦斷層掃瞄儀,仍然是由位於德國漢堡市之飛利浦研究實驗室(Philips Research in Hamburg, Germany)所研發的原型儀器。此些奈米粒子僅在兔子及其他動物模型中試驗過,不過初期的結果證實,成功地從鈣干擾中區分出血液凝塊。
不只能輕易地確認心臟病發作,此些新型奈米粒子及光譜電腦斷層掃瞄儀也能呈現出血液凝塊的確切位置。
當今,即使醫師們診斷病人罹患心臟病發作,倘若病人未在心導管室(cardiac catheterization lab)注入染劑來找尋變窄的動脈,醫師們也無法指出血液凝塊的位置。不過Lanza表示,找到狹窄的動脈並未解決所有問題。
Lanza宣稱:「具有極狹窄通路的動脈不是令人擔心的動脈。因為他們能撐開,於心導管室被發現的那些動脈。」
令人擔心的是,當血液於此些動脈中自由流動時,於動脈壁上有不穩定的斑塊(plaque)。也就是Lanza所謂的中度級病變(moderate-grade disease)。
Lanza宣稱:「多數人的心臟病發作或中風是起因於,使動脈破裂或突然間阻塞的中度級病變。因而,人們需要某種,即使血管不是極狹窄時,也能告知可能有破裂凝塊的方法。」
由於這種奈米粒子找到並附著於血管中的血纖維上,因而能使醫師們得以發現先前難以或不可能察覺的問題。
利用該項造影技術,Lanza預言了諸多治療冠狀動脈疾病的新方法。並未阻礙大量血流的不穩定凝塊無需昂貴的支架來撐開血管。因而,Lanza預見諸多於血管壁中,可能起如同護創膠布(Band-Aids)將易破點加封起來之作用的技術。
Lanza宣稱:「目前,人們不知道於何處黏上護創膠布。不過,藉由鉍奈米粒子的光譜電腦斷層掃瞄造影能顯現凝塊於血管中的確切位置,因而有可能防止造成危害之不穩定凝塊的破裂。」
該項研究是由來自美國心臟協會(the American Heart Association)、美國國家癌症研究所(National Cancer Institute)、生物工程研究合作聯盟(Bioengineering Research Partnership)及美國國家心、肺暨血液研究所(National Heart, Lung and Blood Institute)的補助金所資助。
原文網址:http://news.wustl.edu/news/Pages/21824.aspx
翻譯:peregrine