家裡長輩老是忘東忘西,戴著眼鏡找眼鏡、抹布放到冰箱去,你好心帶他去看醫生還被嫌棄。醫生叮囑要多補充維他命、多吃魚、多動腦、多下棋,儘管如此還是讓人擔心的要命,因為一天一天過去長輩的記憶力似乎沒有回復。
這樣的情況將會越來越普遍。世界衛生組織(World Health Organization, WHO)統計出 2016 世界前十大死因當中,阿茲海默症等失智症排名第五,在當年造成了兩百萬人喪生 [1]。而現在這個時間點,世界上共有五千萬人在阿茲海默症的病程之中。這個數據只會持續惡化,到了 2030 年全球將有七千萬人、2050 年將超過一億三千五百萬人受影響。而屆時阿茲海默症等失智症將會一路躍升成為十大死因的第二名,僅次於心血管疾病。而超過 85 歲的年長者如果僥倖躲過失智症的魔掌,身旁每二到三個人就會有一人失智 [2]。
預防勝於治療,所以我說那個醬汁疫苗呢?
阿茲海默症患者,通常需要他人提供長期的協助及照顧,然而我們是不是能拿回主控權,就如同感冒一樣吃藥了事呢?人類研究出天花疫苗讓天花病毒在地球上消失,那我們是否能夠發明阿茲海默疫苗或阿茲海默藥丸,讓所有人在使用之後永久性地免於記憶剝奪之苦呢?
預防阿茲海默症確實是近年來研究失智症的主要方向之一。2017 年,科學家 Eric McDade 和 Randall J. Bateman 在 Nature 發表一篇評論文章,藉由他汀類藥物(statins)為例,希望科學家能協力找出預防阿茲海默症的方法。他汀類藥物(statins)主要用於降膽固醇,最常見的他汀類藥物便是立普妥(Lipitor),這甚至是史上銷售最好的處方用藥。
有些患者有遺傳性的高血脂和高膽固醇,他們通常在青少年到成年的階段就會發展出心血管疾病,這些患者的平均壽命只有 30 歲。在 2015 年,阿姆斯特丹大學的研究員 Albert Wiegman 發現給予患者他汀類藥物可以有效延長壽命達 15 至 30 年 [3]!這是令人振奮的消息,科學家再次戰勝疾病。Eric McDade 和 Randall J. Bateman 發出宏願,希望科學家們能找到一種藥物以預防阿茲海默症,就如同他汀類藥物成功的預防了早發性的心血管疾病一樣。
要治療就要先了解,阿茲海默症的進程
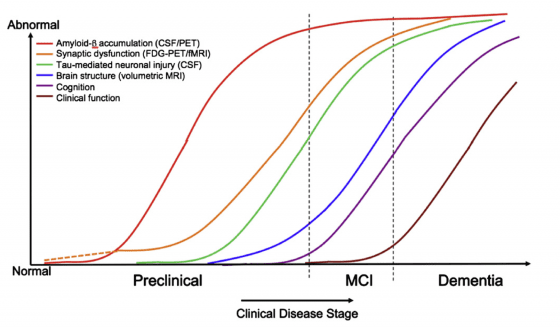
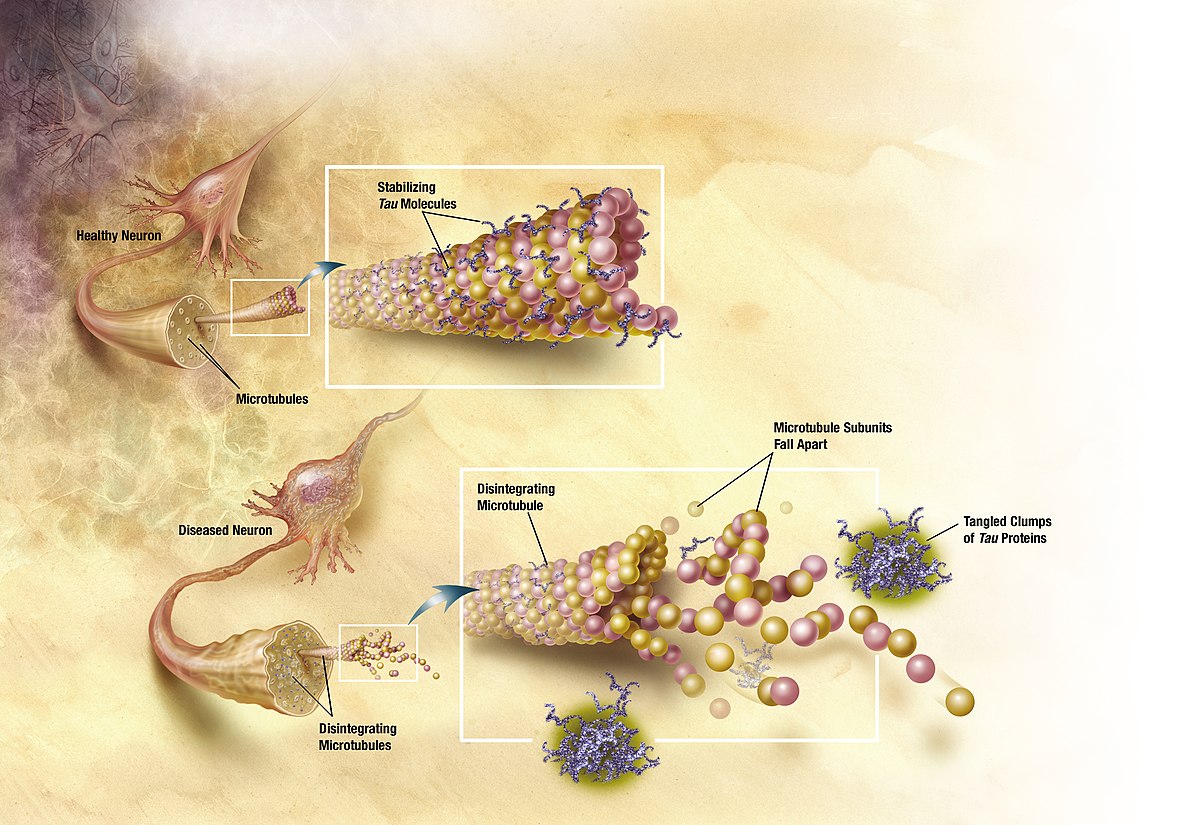
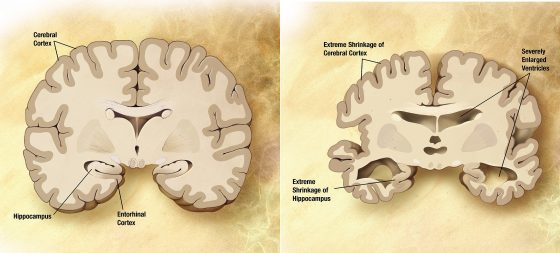
阿茲海默症的成因眾說紛紜,但疾病的進程大約可以由上圖來呈現。橫軸是通往失智症的幾個階段,縱軸則是出現異常的不同指標。可以看到最一開始(紅線)是由類蛋白 Amyloid-beta 堆積在突觸之間,接著會引發濤蛋白(Tau Protein)的纏結(綠線)、腦部結構異常(藍線)、認知失調(紫線),最後步入重度失智的階段。
打比方來說,阿茲海默症的進程就像是放入口袋的耳機線,不斷的纏繞糾結,最後變成一團亂,根本解不開;而最直觀的解決方法就是「預防」耳機線被放到口袋那樣可怕的環境。如果我們可以在類蛋白開始堆積(也就是上圖中紅色的線)之前就介入治療,想必會是最有效的預防方法。然而這並非容易的事情,要如何在患者完全沒有症狀的時候就診斷出有病症呢?這就好比還沒感冒就去看醫生,希望醫生能從你身上的蛛絲馬跡判斷你將來會不會生病一般。幸好透過日新月異的影像技術,科學家們可以在越來越早期的進程開始治療,甚至可以利用基因篩檢找出極有可能得到遺傳性阿茲海默症的患者,在他們沒有任何症狀的時候便開始治療。

類蛋白出來面對啊
大部分的科學家都同意類蛋白 Amyloid-beta 是非常好的觀察目標,將類蛋白清除似乎是預防阿茲海默症的好方法,因為有大量類蛋白堆積的患者幾乎都會發展出阿茲海默症,而且在上圖中的紅線可以看出類蛋白的堆積發生於所有事件的前端:就像是第一張骨牌一樣,只要防止它發生,後面的骨牌就會安然無恙。
然而在 2014 年,英國的科學家 Eric Karran 發表一篇文章質疑類蛋白假說,認為過去五年內針對類蛋白為治療目標的六個第三期臨床實驗都宣告失敗,Eric Karran 推測是因為由類蛋白堆積作為起點的假說不正確 [4],才會導致這麼多的臨床實驗都失敗。而另一部分的科學家卻樂觀地認為那是因為不夠早開始治療,他們認為會無效是因為第一張骨牌已經倒塌了,後面已經開始連鎖反應:濤蛋白開始無限纏結、腦部結構也逐漸異常。這時候即使設法清除類蛋白也無用武之地。換言之,如果能在一開始就不讓類蛋白在腦中堆積,也許便可以預防阿茲海默症,讓人們免於失去記憶之苦。

任何研究都需要時間以及經費,在 2015 年,全球投入了超過 25 兆元台幣在研究阿茲海默症。阿茲海默症的進程往往長達數年,科學家們希望能用歲月換來對阿茲海默症病情的掌控、以及人們對記憶的主控權。我們也不必對此感到失望或焦急,也許將來真能開發出阿茲海默症的預防針或是口服疫苗也說不定。或許以後在掃完核磁共振之後,醫生便會跟你說:「嘿!你是阿茲海默症的高風險群,不過只要按時服藥就沒問題了!」
參考資料
- Global Health Estimates 2016: Disease burden by Cause, Age, Sex, by Country and by Region, 2000-2016. Geneva, World Health Organization; 2018.
- McDade, E., & Bateman, R. J. (2017). Stop Alzheimer’s before it starts. Nature News, 547(7662), 153.
- Wiegman, A., Gidding, S. S., Watts, G. F., Chapman, M. J., Ginsberg, H. N., Cuchel, M., … & Bruckert, E. (2015). Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. European heart journal, 36(36), 2425-2437.
- Karran, E., & Hardy, J. (2014). A critique of the drug discovery and phase 3 clinical programs targeting the amyloid hypothesis for Alzheimer disease. Annals of neurology, 76(2), 185-205.
(責任編輯/蔣維倫)