由蛇毒蛋白到研究 RNA 剪接
回想四十年前,鄭淑珍還是臺灣大學化學系的大四生,跟著羅銅壁院士做專題研究,以蛇毒蛋白為材料。「這跟作化學實驗很不一樣,感覺跟生命比較有連結,有很多自然奧秘等待被開發!」鄭淑珍回想喜歡上生化實驗的日子。
四十年過去,鄭淑珍仍投身於基礎研究,只是對象不再是蛇毒蛋白,而是生物體內 RNA 剪接的奧秘。電影剪接教父 Walter Murch 曾說:「最好的剪接,是像眨眼一樣自然」。而在自然界中,眨眼一瞬間、甚至比眨眼更快的瞬間,生物體內也有許多「 RNA 剪接」正在進行中。
中心定律:DNA>RNA>蛋白質
瞭解 RNA 剪接之前,我們要先對生物的中心定律 (Central Dogma)──「從 DNA 到蛋白質」這過程有個概念:
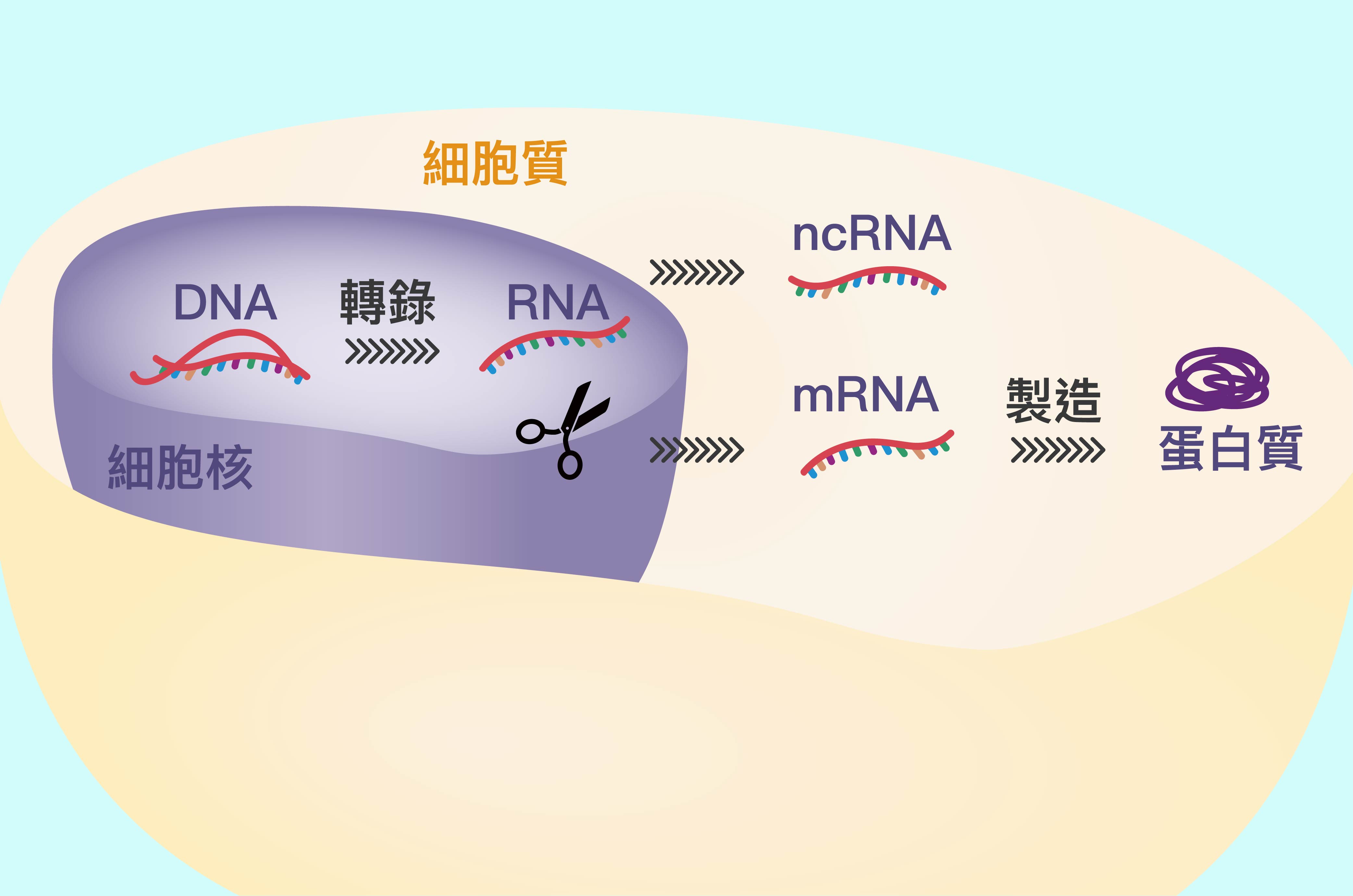
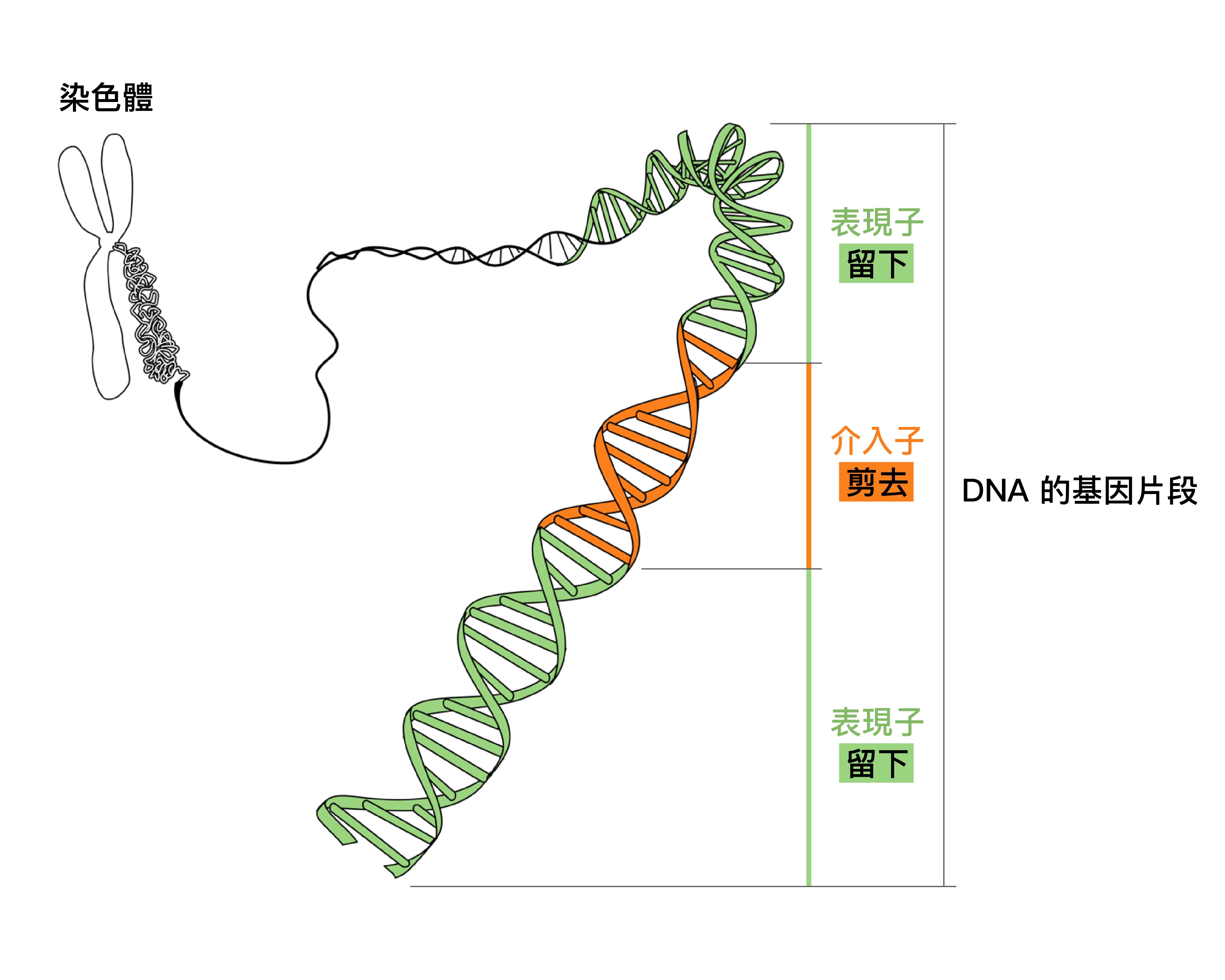
「表現子」在 RNA 剪接時會被「留下」,而「介入子」會在 RNA 剪接時被「捨去」。保留的表現子被組成一段 mRNA 遺傳訊息,並依此 mRNA 遺傳訊息製造出對應的蛋白質,蛋白質再於生物體內發揮應有的功能。
人體中所有的表現子,也就是能夠製造蛋白質的基因編碼,其實只佔人體基因體總長度 1.5% 。為什麼這麼少的基因,卻能組合出人體中那麼多種複雜的蛋白質?又或者,為什麼有些情況下, 表現子的 DNA 序列明明無異常,卻產出奇怪的蛋白質,導致生理異常或遺傳性疾病?
奧秘在於「 RNA 剪接」是否正確運作:剪掉不要的介入子,並保留、組裝需要的表現子。
剪接奧秘在於精準「捨」與「留」
「電影剪接,主要是透過『減法』來達成的一門藝術,否決那些對最終成果無用的元素。這個形式不只是由保留了什麼來決定,被刪除了什麼也同等重要。」——《剪接師之路》作者 Justin Chang 。
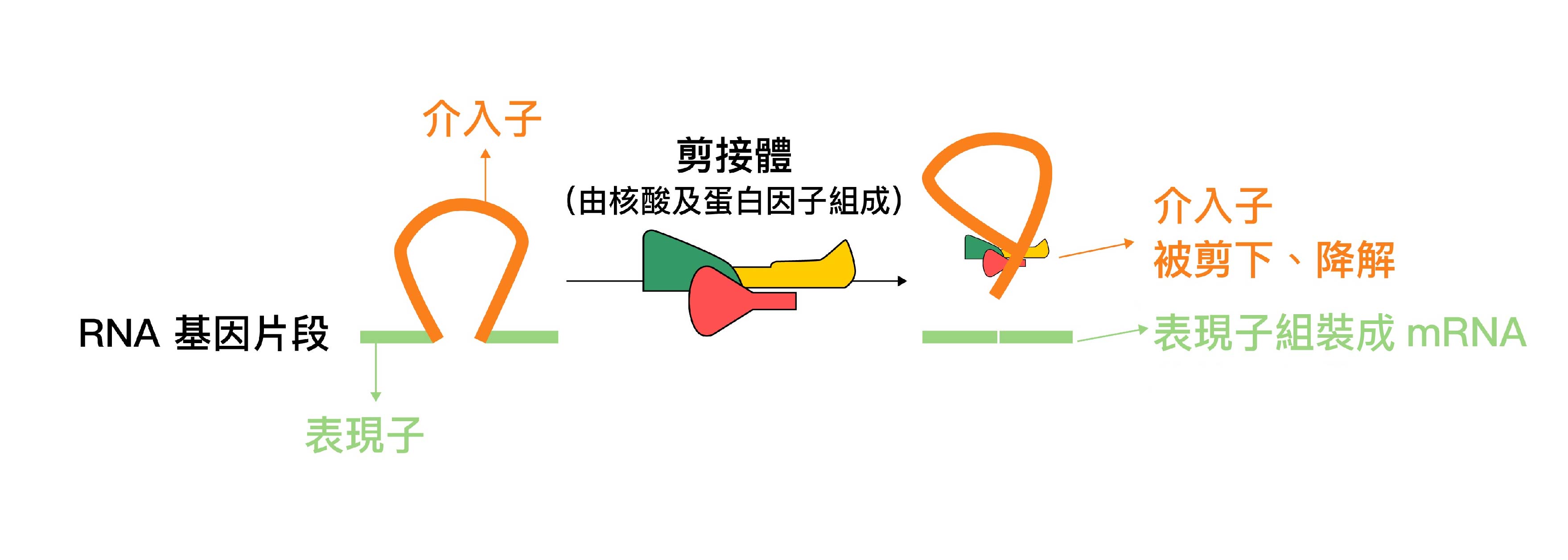
這個心法不單指電影剪接,生物體內的 RNA 剪接也是。我們可試著將 RNA 剪接加工成 mRNA 的過程,想像成下圖。

RNA 基因片段,是根據 DNA 電影腳本拍攝出來的影片片段,而剪接體 (Spliceosome)就像生物體內的剪接師團隊,將需要的影片片段留下來組裝、說成有意義的故事情節,而不需要的鏡頭畫面,就如同被剪去的介入子。
若某一步驟剪錯,少了、或多了一段影片片段,電影情節就會讓人滿頭問號。情節錯誤的電影,如同最終產出的錯誤蛋白質,讓體內生理機制也滿頭問號,導致生理異常或遺傳性疾病。
以酵母菌為模式,建構 RNA 剪接路徑
要瞭解 RNA 剪接哪裡出錯,需先透徹瞭解剪接路徑。鄭淑珍團隊以酵母菌為模式系統,透過實驗拆解 RNA 剪接加工成為 mRNA 的步驟,找出是哪些「剪接師」也就是蛋白因子、蛋白複合體參與其中。
酵母菌這種單細胞生物,有辦法幫助瞭解人體嗎?鄭淑珍說明,RNA 剪接是真核生物體內一個基本的生化反應,在各種生物中機制大致相似。雖然人體比酵母菌複雜很多,但人體的基因數量其實只有酵母菌的四倍。
高等生物體內,一段基因編碼做出不只一種蛋白質,就是利用「剪接」排列組合來達成。
多年來的努力,結合其他研究團隊提供的資訊,對剪接路徑的認知整合於下圖呈現。簡單來說,RNA 剪接過程可分為四個階段:組裝、活化、催化、拆解。過程中,由五個小核核醣核酸及多種蛋白因子組成剪接師團隊,擔綱剪接任務。
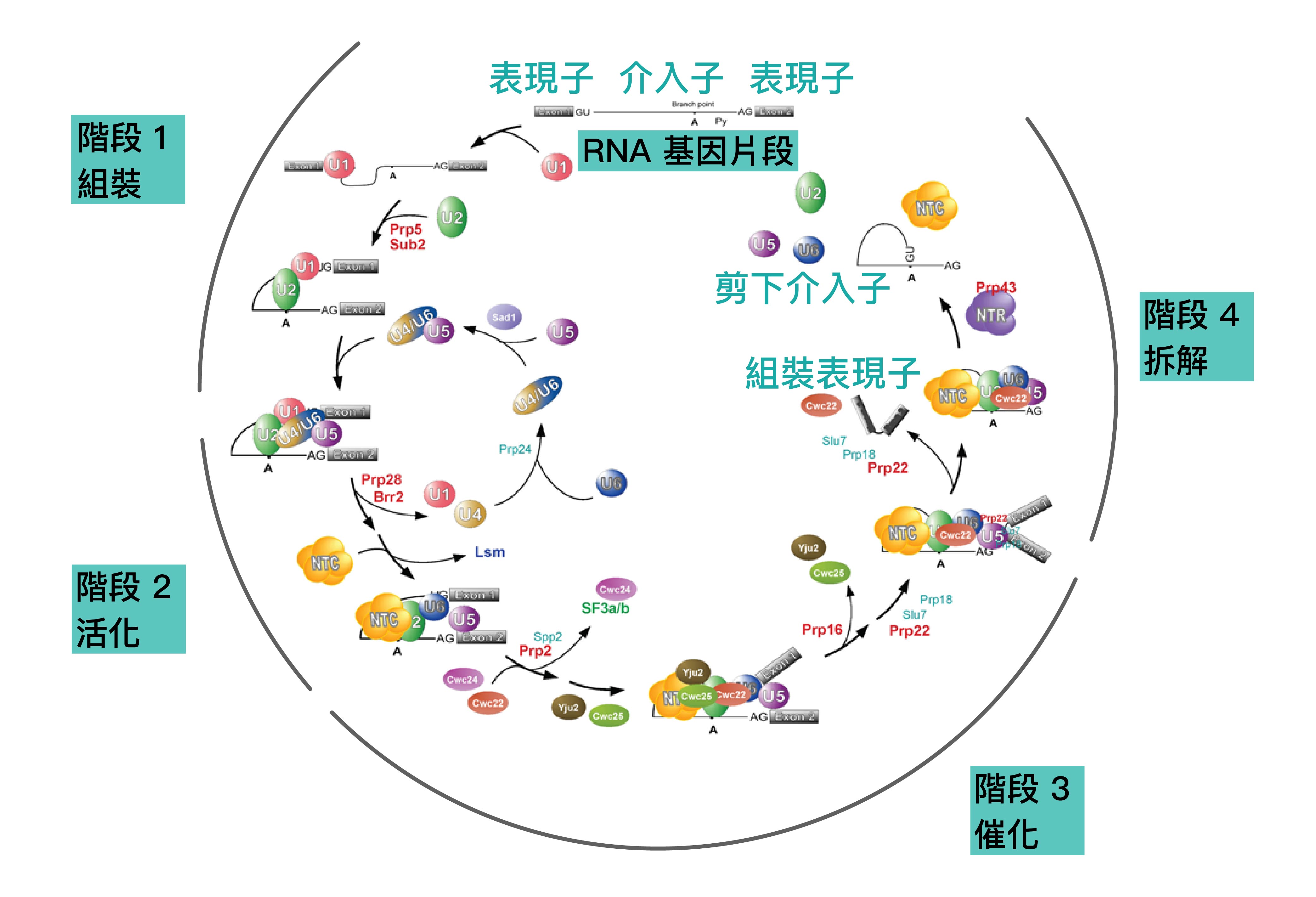
在 RNA 剪接過程中,有些蛋白因子負責將要被組裝的表現子拉近一點,有些蛋白複合體(例如 NTC)負責活化結構、催化剪接反應。有些蛋白複合體(例如 NTR)負責拆解結構,讓蛋白因子可以重新參與下一次剪接輪迴。
其中的 NTC、NTR 蛋白複合體,和 Cwc22、Cwc24、Cwc25、Yju2 等蛋白因子,一開始沒人知道它們的存在與功能,直到鄭淑珍團隊透過生化實驗,一一拆解 RNA 剪接步驟,才發現這些參與反應的「剪接師團隊」。
自然情況下,生物體內的剪接過程有可能會出錯,例如,當剪接蛋白因子都被套牢在 RNA 基因片段上,導致新的 RNA 沒有人手來剪接,就會對細胞產生不良影響。可以想像成,當剪接師團隊全都卡在同一個電影專案、白費功夫,就拖累了後續新電影的剪接進度。
冷凍電子顯微鏡:親眼瞧瞧 RNA 剪接團隊
反覆的生化實驗操作,仔細偵測實驗產物的變化,並運用想像力推論變化的原因。雖然耗時費力,鄭淑珍認為:「實驗程序必須很扎實,才能獲得確實的結果 。很多時候實驗會碰到瓶頸,無法破解。但當想了很久終於想通了,是做研究最開心的時候!」
不少遺傳性疾病跟 RNA 剪接有關,但要以此發展藥物,必須徹底了解 RNA 剪接途徑的機制,才能對症下藥。很令人振奮的, 2016 年底美國食品藥品監督管理局 (FDA) 批准了一個治療脊髓性肌肉萎縮症 (SMA) 的藥,可以矯正調控病患運動神經元蛋白質的 RNA 剪接異常。鄭淑珍提到,此外國團隊在這方面不放棄地研究了二十多年,並攜手生技公司、藥廠合作開發新藥。
國際上除了脊髓性肌肉萎縮症 (SMA)藥物研發成功的激勵,RNA 剪接研究也照進另一道曙光。
以前是透過生化實驗來「推論」 RNA 剪接途徑。近年由於冷凍電子顯微鏡技術的大精進,解出了剪接複合體的複雜結構,可以看到剪接途徑不同階段的剪接體結構細微的部份,相當於直接「看見」RNA 剪接過程,也應證過去的實驗推論。這令研究人員們內心狂喜,因為剪接體的結構既複雜又不穩定,過去很難想像其結構能輕易解出來。
「很多這個領域的創始元老,現都已八十多歲,沒想到有生之年可以親眼看到這些結構,他們都很開心!」說著這段話的鄭淑珍,眼中也帶著期待。
雖然多瞭解了很多,但還有很多需要被瞭解,所以我們就在這個領域繼續做。
RNA 剪接正發生在你我體內,此領域雖已累積不少研究發現,但還有很多需要被探究。多瞭解它們一些,就給我們更多機會去對付因剪接缺失所造成的疾病。
延伸閱讀
- 鄭淑珍的實驗室網頁
- Chan, S.-P., Kao, D.-I., Tsai, W.-Y. and Cheng, S.-C. (2003) The Prp19p-associated complex in spliceosome activation. Science 302, 279-282.
- Tsai, R.-T., Fu, R.-H., Yeh, F.-L., Tseng, C.-K., Lin, Y.-C., Huang, Y.-h. and Cheng, S.-C. (2005) Spliceosome disassembly catalyzed by Prp43 and its associated components Ntr1 and Ntr2. Genes Dev. 19, 2991-3003.
- Tseng, C.-K. and Cheng, S.-C. (2008) Both catalytic steps of nuclear pre-mRNA splicing are reversible. Science 320, 1782-1784.
- Liu, H.-L. and Cheng, S.-C. (2012) The interaction of Prp2 with a defined region of the intron is required for the first splicing reaction. Mol. Cell. Biol. 32, 5056-5066.
- Liang, W.-W. and Cheng, S.-C. (2015) A novel mechanism for Prp5 in prespliceosome formation and proofreading the branch site sequence. Genes Dev. 29, 81-93.
- Wu, N.-Y., Chung, C.-S. and Cheng, S.-C. (2017) Roles of Cwc24 in the first catalytic step and fidelity in 5’ splice site selection. Mol. Cell. Biol. 37, e00580-16.
本著作由研之有物製作,原文為《我們體內竟然住著剪接師!鄭淑珍的 RNA 剪接研究》以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位