- 文/ Wayne,FB粉絲頁-Medinno Catalyst 醫療器材催化器管理人,專注在醫材的尖端技術、市場動態與法規政策等資訊,
不定期發佈評析專題,為醫材業界人士提供最新最完整的產業情報。
今年(2017年)二月底美國食品藥物管理局(FDA)發布公告,提醒國內所有健康照護供應商應當要去追蹤一種創新醫療器材——膠囊胃氣球(Bioenteric intragastric balloon)的使用情形,因為美國 FDA 已經接獲數十起關於該產品的不良事件通報。
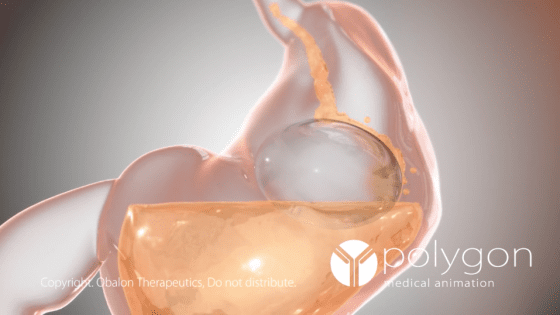
減肥市場的新寵兒——胃氣球
膠囊胃氣球是一款用來幫助病人減肥的醫療器材,他的產品概念是膨脹的氣球會佔據胃的大部分的空間,且帶有一定重量,會使病人產生飽足感,有效的降低病人的進食慾望。醫生可以透過內視鏡將帶有扁平氣球的膠囊送到病人的胃裡,再利用內視鏡注射 700 到 900 毫升的食鹽水到氣球內,讓氣球在胃裡膨脹到一定的程度。這個氣球可以在胃裡維持六個月,接著就會慢慢縮水,再用內視鏡取出胃氣球的殘骸。
在膠囊胃氣球上市之前,並沒有類似的產品,胃氣球被認定為創新的醫療器材,美國 FDA 對於創新性醫材的審核極為嚴格,廠商需要舉行大量的臨床試驗,還有提出可靠的報告才能說服美國 FDA,因此目前有成功申請到美國上市許可的廠商只有 ReShape 跟 Apollo。
意想不到的產品風險
然而,理想是美好的 現實是骨感的。這款創新產品從 2015 年推出後,便陸陸續續傳出產品使用不當或是病人植入胃氣球後出現不好的症狀等負面消息。
在產品使用不當的案例中,最常見的是醫師沒有依說明書上建議的食鹽水體積,自行決定注射更多的食鹽水到氣球內,使得氣球過度膨脹,導致病人有嘔吐或是呼吸困難的症狀。
為什麼醫生會注射過多的食鹽水呢?原因可能是醫師或是病人希望有更好的治療效果,所以想藉由增加氣球體積來降低食慾。不過廠商提供的說明書裡,沒有特別強調如果注射過量的食鹽水會發生什麼事情,也沒有禁止或是警告醫生進行這樣的行為。

所有廠商提供的說明書都是有經過美國食品藥物管理局(FDA)審核,很顯然地,美國 FDA 官員們亦沒有想到會有這樣子的操作風險,所以他們沒有要求廠商特別加註。
另外一種不良事件是,有些病人在植入胃氣球的三天內會有腹痛和背痛的症狀,經確診後,發現這些病人罹患了急性胰臟炎。目前初步推測原因可能是膨脹後的胃氣球帶有一定的重量(約 700 到 900 克),他會長時間的壓迫胃下方的胰臟;也有可能是膨脹的胃氣球會改變腸胃之間的結構,影響胰臟正常運作。

像是急性胰臟炎這類型的不良事件就很有意思了,我們發現在廠商說明書中,有提到病人在植入後幾天內可能會發生腹痛,但是並沒有提到會發生急性胰臟炎。就因果順序來看,這些病人應該是先得了急性胰臟炎,才產生腹痛的現象,那麼廠商當初在說明書上寫道可能會發生腹痛的副作用時,是否有先去探討時什麼原因導致腹痛嗎?美國 FDA 在審查過程中,是否有從廠商提供的臨床報告裡看到發生腹痛的臨床案例呢?這些報告裡有沒有去分析腹痛的背後原因?由於這些都是非公開資料,我們也無從得知。
美國 FDA 的處理方式
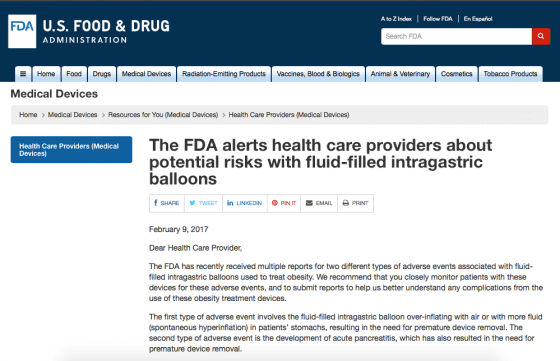
在接獲數十起不良事件通報後,美國 FDA 也在官方網站上發表聲明,提醒供應商們須注意植入膠囊胃氣球後可能會發生ㄧ些異常狀況,如果有發現異常狀時,請務必自主通報給 FDA,供應商可以利用手機上的 MedWatch APP 進行通報,也可以直接上美國 FDA 官網進行通報程序。美國 FDA 會與 ReShape、Apollo 這兩家廠商聯合調查不良事件的實際狀況,美國 FDA 亦會視情形嚴重程度發布產品召回的公告。
醫勞器材法規小學堂
不論是我國還是美國的藥事法裡,都有專屬的法規來規定醫材事故通報,裡面包含了發現不良醫材時我們該如何通報,還有通報給當地衛生主管機關時需要提供那些資訊。負責的主管機關會依據通報內容,將不良事件分類到「藥物不良反應」、「產品本身問題」、「產品操作錯誤」其中之一。
「藥物不良反應」是泛指所有患者在使用醫療器材時產生任何的不舒適,像是頭痛,腹痛……等都會被記錄在內。但是,政府會特別注意是否有發生「嚴重不良反應」,嚴重不良反應的定義是患者在使用醫療器材時發生「死亡」、「危及生命」、「造成永久性殘疾」、「胎嬰兒先天性畸形」、「導致病人住院或是延長病人住院時間」和「其他可能導致永久性傷害」這六種情形其中之一,只要發現這上述情況,就需要在通報申請書裡特別加註 。
追求創新與安全的平衡
每項醫療器材需要先獲得當地衛生主管機關的核准,才能在市面上販售,在審核階段時,主管機關會要求廠商提供產品的相關資料,來證實醫療器材的安全性和有效性,另外,政府也能利用目前市面上相似的醫療器材,來訂定相關的規範。但是創新的醫療器材,往往是無例可循的,政府只能依據廠商宣稱的產品功能,用想像力去推測產品在使用的過程中可能會有哪些風險,或是產品會對人體造成那些傷害,但很遺憾的是,總是有無法預測的情況出現。

然而,無可否認的是,現在我們能享有先進的醫療,很大一部分是由於醫療器材的進步。我們不能因為害怕創新產品帶有較多的未知風險,而捨棄追求更好的醫療器材。我們應該要去思考,如何在創新與安全之間找出一個最佳平衡點。
參考資料:
- 1. The FDA alerts health care providers about potential risks with fluid-filled intragastric balloons
- 2. 美國FDA網站