- 採訪/趙軒翎|泛科學內容編輯
- 撰文/楊仕音
真的存在肥胖體質嗎?
「體質」一詞聽來玄虛,但有過減重經驗的人應該對個體差異相當有感——有些人吃再多也不易發胖,可有些肥胖體質的個體卻沒辦法這麼有口福了。

肥胖體質到底是什麼?無論是先天因素或後天因素所致,肥胖體質可以簡化成「生態系」一詞。提到「生態系」,絕大多數人首先聯想到的可能是地球上所有相依相存的生物和生存環境。其實,我們每個人身上隨時都攜帶著一座專屬生態系,而近來科學家目光的焦點——腸道生態系——與肥胖體質之間的關係密不可分。
腸道生態系是一座住滿各式各樣微生物的部落,稱為「腸道菌相」(gut microbiota)。台灣國家衛生研究院免疫醫學研究中心高承源助研究員團隊 [註 1],發現調控腸道菌相平衡的新機制,並且進一步證實特定腸道菌相能有效增加個體的代謝率和能量消耗,抑制因飲食引發的肥胖症。此研究成果已發表於國際知名期刊《自然微生物》(Nature Microbiology)。
如何確認基因功能?
過去的研究顯示,小鼠體內的遺傳基因 DUSP6 與飲食誘發型肥胖症(diet-induced obesity)所導致之脂肪肝和糖尿病等徵狀息息相關,因此研究團隊決定鎖定該基因,分析它的功能作用是否可以改變小鼠對飲食誘發型肥胖症的反應與腸道菌相組成。
然而,即使只是單一基因的表現與調控機制,在活體內由於受各種因子交互影響,追蹤起來比想像中的複雜許多,所以科學家採用的方式多半是「從缺陷中尋找線索」。換句話說,即是先將 DUSP6 基因剔除,再觀察缺少該基因的小鼠腸道生態系發生了什麼事。

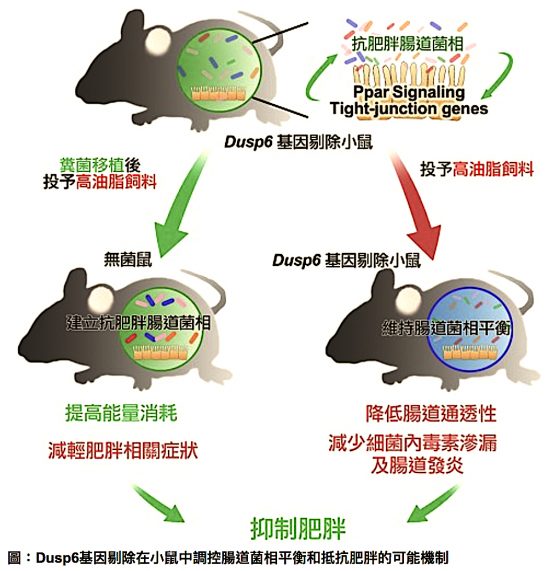
第一步,研究團隊將 DUSP6 基因剔除小鼠與對照組的小鼠做比較,同時餵食兩組小鼠高脂肪飼料。結果發現 DUSP6 基因剔除小鼠雖然攝食量沒有減少,但血糖耐受度和胰島素敏感度增加 [註 2]、脂肪肝發生率低,更重要的是脂肪細胞還會恢復正常大小,進而抑制體重增加 [註 3:肥胖細胞的數量不會減少,但本身會縮小]。
看到這個結果,研究團隊覺得相當驚奇,因為這類基因剔除實驗,科學家通常預期有缺失基因的個體,健康狀態會變得比正常個體差,沒想到在這個實驗中卻發現,缺少 DUSP6 基因的小鼠不但沒有變胖,反而還能抑制肥胖。高承源博士表示,起初,團隊有些懷疑自己的研究結果,但就在一、二個月後,美國另一個研究團隊竟然發表了一篇文獻,他們所觀察到的現象與國衛院團隊相似。不僅如此,美國實驗團隊研究中所提到的 DUSP6 基因對於肝臟代謝相關機制的影響,正是原本國衛院團隊接下來打算探討的題目。「我們覺得這件事有好有壞,」高承源說,「好的是他們的論文增加了我們對研究結果的信心,但也表示我們得另尋研究方向了。」
便便中藏有腸道菌的秘密
DUSP6 基因剔除小鼠是透過什麼樣的機制,來讓同樣吃高脂肪飼料的小鼠,達到抑制體重增加的效果?這和我們一開始提到的腸道生態系有沒有關係呢?高承源博士的團隊接下來試著從腸道菌切入,而要取得 DUSP6 基因剔除小鼠的腸道菌,就得從牠的「便便」下手了。
沒有錯,便便中藏有生物的腸道菌密碼,要知道這些腸道菌對於肥胖有沒有影響,就得將這些腸道菌移植到另一隻小鼠身上,再仔細觀察牠的身體反應和變化。所以研究團隊將 DUSP6 基因剔除小鼠(以下簡稱移植鼠)的便便,移植至野生型小鼠(以下簡稱被移植鼠)身上。聽起來很可怕,但這也是為了讓你這小胖子別再胖下去實驗需求。結果發現,被移植鼠不僅能量消耗增加,並且與移植鼠一樣,具有抑制高脂飼料所造成的體重增加、脂肪細胞肥大、脂肪生成與脂肪肝等症狀的能力。
這代表 DUSP6 基因剔除小鼠的腸道菌中,藏有一些能抑制肥胖的秘密武器囉?
研究團隊進一步分析 DUSP6 基因剔除小鼠小腸組織內的 RNA 表現,發現 DUSP6 基因缺失會加強細胞緊密度相關的基因表現(gene expression);也就是,DUSP6 基因剔除小鼠可藉由增加細胞緊密度、降低腸道上皮細胞的通透性,來維持腸黏膜與腸道菌相間的平衡,並且避免細菌內毒素滲漏至血液循環、引起全身性慢性發炎。簡單來說,細胞間的連結愈緊密,上皮細胞的屏障效果就像座固若金湯的城堡,難以被外來病原攻陷,因此可保護原始健康腸道的菌相平衡不被破壞。此外,DUSP6 基因剔除小鼠還能逆轉因高油脂飼料擾亂的腸道基因群表達,降低高油脂飼料引致的 T 細胞發炎反應,藉穩定腸道免疫調節來維持有利於個體代謝之菌相,形成個體體內一個「吃不胖的腸道生態系」。
小鼠歸小鼠,那能不能抑制我的肥胖?

看到這裡大家最關心的應該是,那在人身上 DUSP6 基因剔除個體的腸道菌,究竟有沒有辦法幫助我們抑制肥胖啊?
高承源博士說,人身上確實也有 DUSP6 基因,但要了解人身上的作用機轉,實際上非常困難。科學家無法像製作基因剔除鼠一般任意的操弄人身上的基因,通常得透過醫院蒐集到相關案例或樣本來分析。臨床案例樣本分析在癌症研究上常用,可是癌症相關的疾病手術機會多,自然也有較多檢體,但肥胖(或是抑制肥胖)的檢體到底該去哪裡搜尋,就令人頭大了。
當然團隊也希望最終可將此機制,應用於人體肥胖及相關代謝疾病的治療和預防。目前研究人員正著手深入分析 DUSP6 基因剔除小鼠糞便中的腸道菌相,試圖篩選並培養出具有可幫忙人類抑制肥胖效果的腸道菌株。
從腸道生態系改變肥胖體質的未來或許離我們不遠,但在科學家實現這個美夢之前,面對農曆春節滿桌的大魚大肉,還是得多加節制;即使不是為了保持身材,也需留意因口腹之慾而帶來血糖、血脂飆高等健康風險。
註解
- 本次實驗研究團隊,包括國家衛生研究院免疫醫學研究中心高承源博士、阮振維博士、助理黃芝婷,於免疫醫學研究中心譚澤華主任提供之基因剔除小鼠及相關資源支持下,與美國 Sarah Statt 博士、清華大學詹鴻霖教授及博士生蔡伊葶、國衛院細胞與系統醫學研究所郭呈欽研究員、群體健康科學研究所廖玉潔研究員等人組成的跨領域團隊。
- 胰島素控制血糖平衡,促使肝臟、肌肉將血液中的葡萄糖轉化為肝醣儲存,所以當身體對胰島素變得不敏感時,需要分泌更多胰島素身體才會有反應,最後產生胰島素的細胞過度疲勞,便不再分泌胰島素,葡萄糖耐受度降低,血糖居高不下,最後轉為糖尿病。
- Spalding K.L., Arner E., Westermark P.O., Bernard S., Buchholz B.A., Bergmann O., Blomqvist L., Hoffstedt J., Näslund E., Britton T., Concha H., Hassan M., Rydén M., and Frisén J., Arner P. (2008) “Dynamics of fat cell turnover in humans.” Nature 453 (7196), 783-787.
原始研究
- Ruan, J.W., Statt, S., Huang, C.T., Tsai, Y.T., Kuo, C.C., Chan, H.L., et al. (2016) “Dual-specificity phosphatase 6 deficiency regulates gut microbiome and transcriptome response against diet-induced obesity in mice.” Nature Microbiology (16220), 1-12.