炎炎夏日,來上一口冰涼的飲料能讓人快速消暑,但對於有敏感性牙齒的人來說,這一口冰涼飲料雖能消暑,卻換來又痠、又痛的牙疼,根據統計,約有 44% 的國人為敏感性牙齒所困1。
拜「抗敏感牙膏」的電視廣告所賜,民眾普遍對敏感性牙齒的症狀並不陌生,然而,敏感性牙齒的精準定義是什麼?人們又為何會罹患敏感性牙齒呢?近期發表在 Science Advances 的研究,讓我們能一窺造成敏感性牙齒的可能機制2。

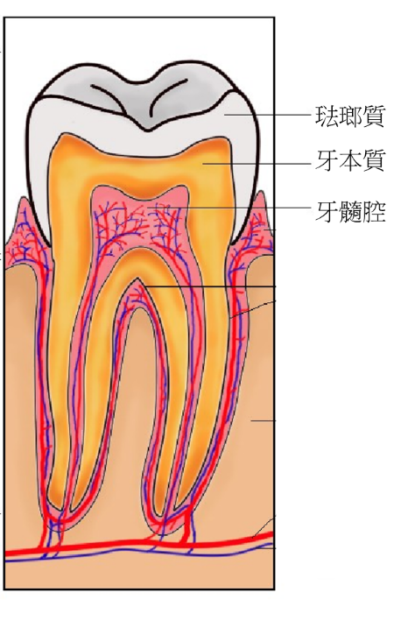
小小白色牙齒的內部構造
敏感性牙齒的正確名稱是「牙本質知覺敏感症」,要了解其中的原因,得先聊聊牙齒的構造。
人類的牙齒由外到內由三個部分組成:
- 琺瑯質:主要由鈣和磷所構成的堅硬外層,其功能為磨碎食物與保護牙本質。琺瑯質是人體內最堅硬的組成,但無法再生。
- 牙本質:構成牙齒主體的微黃色組織,終身都會繼續不斷地再生。
- 牙髓腔:牙齒核心,包含神經和血管等各類軟組織。
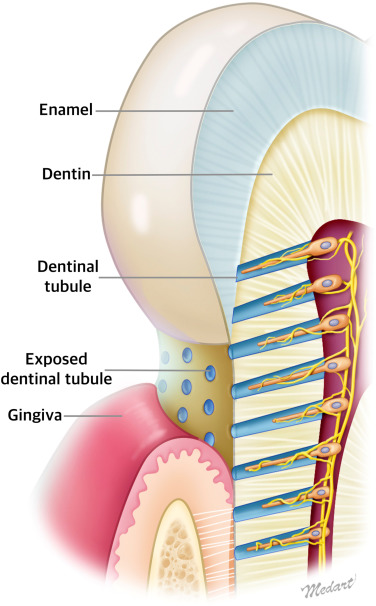
當琺瑯質因各種因素 (例如刷牙太大力、酸性物質腐蝕、蛀牙等)被耗損後,琺瑯質就會無法繼續保護牙本質,並讓牙本質暴露出來,一旦牙本質暴露後,外界的各種刺激像是溫度變化、酸性物質等就會直接影響牙本質,讓我們感到牙齒的痠軟或疼痛。
當牙本質被「見光死」後,為什麼會痛?
細看牙本質後,我們可以發現它由許多貫穿整個牙本質的牙本質小管構成。雖然牙本質沒有神經細胞分布,但位於牙髓腔內的神經細胞,其末梢會分布在充滿液體的牙本質小管內。
目前學界認為,這些液體正是導致敏感性牙齒的元凶。
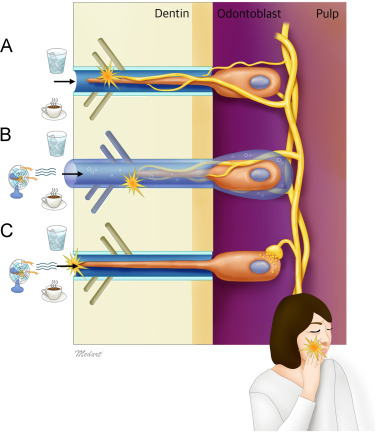
關於敏感性牙齒來源的主流解釋是這樣的:
正常的牙本質會有琺瑯質的保護,讓外在因素不會直接影響牙本質小管,但當牙本質小管外露,外在因素的刺激很容易改變牙本質小管的壓力,進而使牙本質小管中的液體快速流動。這個液體流動速度的改變,會刺激牙本質小管內的牙髓神經末梢,進而引發神經衝動導致疼痛發生。
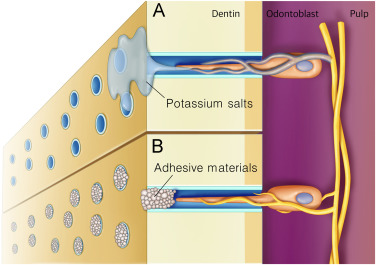
那麼該如何處理敏感性牙齒呢?
由於敏感性牙齒是因為牙本質暴露並受到外在刺激所導致,因此只要不讓牙本質與外界接觸,就能有效阻止疼痛發生。
理論上最好的辦法是讓琺瑯質包裹住牙本質,但正如前文提到,琺瑯質是無法再生的,因此人們退而求其次,想辦法使用其他物質來封住牙本質小管,使其不會受到外在因素的刺激,而這也是市售抗敏感牙膏的抗敏機制。
然而,以上僅僅只是學界的「主流觀點」,關於「牙本質小管內的液體流動是導致敏感性牙齒的主因」一說,尚未被有足夠的實驗和證據支持。
本文接下來將介紹近期發表在 Science Advances 的研究,這篇研究將針對敏感性牙齒的成因提出可能的分子機制。
十五年前的博士後研究:TRPC5 的發現
這項研究的開端要追溯到十五年前。
當時,此篇論文的主要作者 Katharina Zimmermann 正在進行博士後研究,她和團隊發現了一種叫作 TRPC5(Short transient receptor potential channel 5)的離子通道蛋白質。
這個 TRPC5 是甚麼?讓我們先從傷害受器說起。
傷害受器(nociceptor)是中樞神經系統中的感覺神經元之一,當人體遇到高溫或強酸等的刺激時,傷害受器會被活化,並將訊號傳至中樞神經 (延髓和大腦),讓人產生不適甚至是疼痛感,使我們避開這些可能造成傷害的危險。
依據接受的刺激不同,傷害受器可分為溫度感受、機械感受和化學感受。而人體專司溫度感受的傷害受器,主要是靠感覺神經元細胞膜上的瞬態感受器電位通道 (Transient Receptor Potential Channel, TRP)這個離子通道蛋白質來接收刺激。
針對不同的溫度刺激,會有不同的 TRP 蛋白來對應。
例如目前了解最多的是 TRPV1,它會對高溫作出反應,當 TRPV1 在 42℃ 以下時,通常不會活化,但一旦皮膚超過該溫度,傷害受器中的 TRPV1 就會活化,並把信號傳輸到中樞神經,讓你產生灼熱和疼痛感。
另一例是 TRPM8 ,TRPM8 對低溫刺激 (10-30℃) 有反應,不過和 TRPV1 不同的是,TRPM8 的活化是讓人感到清涼,而不是疼痛。
除了溫度會活化 TRP 蛋白,一些化學物質也會活化 TRP 蛋白:例如辣椒中的「辣椒素」就會活化 TRPV1;薄荷中的「薄荷醇」會活化 TRPM8。
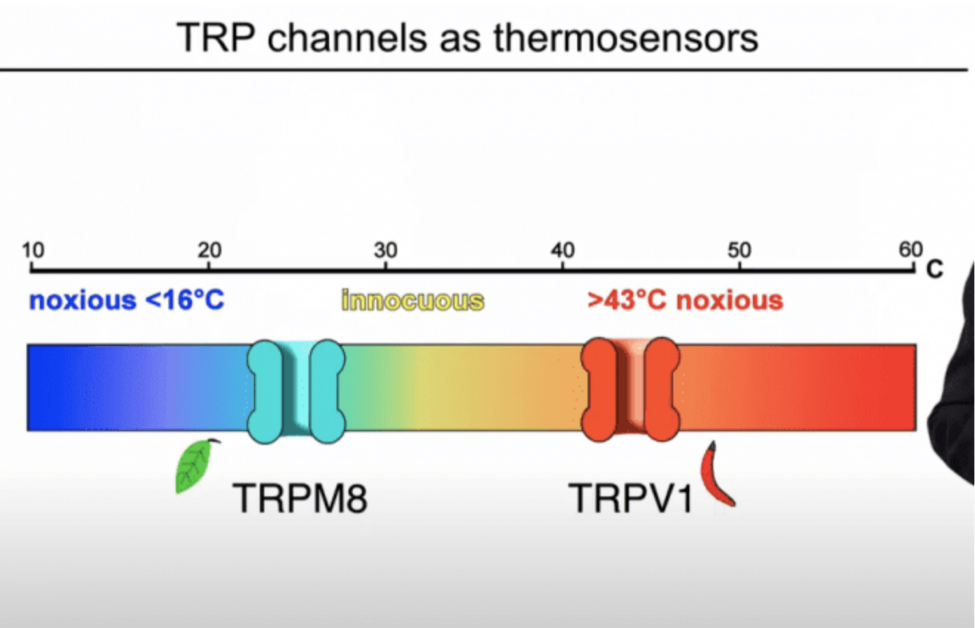
而 Zimmermann 所發現的 TRPC5 對寒冷極為敏感,但她和研究團隊發現 TRPC5 和 TRPV1、TRPM8 不同,作用位置並不在人體的皮膚上,而這讓他們的研究陷入了死胡同。
身體哪個部分也怕冷?報告:牙齒!
一天,研究團隊在午餐會上討論研究進度時,突然有人對 TRPC5 的研究提出新的想法。Zimmermann 回憶道,那時大家正在吃飯,突然有人提出:「牙齒也是人體對寒冷極為敏感的部位啊!」而這個想法,開啟了團隊的新研究方向。
雖然這個想法似乎為研究團隊開啟一道曙光,但想要研究牙齒沒這麼容易。當科學家想要研究牙齒的內部時,勢必要切開琺瑯質和牙本質這兩層硬度很高的物質,而且這個過程還不能傷到牙齒內部柔軟的牙髓。
然而,許多有經驗的研究人員都知道,在切開牙齒的過程中,整顆牙齒四分五裂是相當稀鬆平常的。
後來 Zimmermann 的團隊改變思路,他們沒有切開小鼠的牙齒,而是選擇研究整個牙齒系統:包括頜骨、牙齒和牙神經。
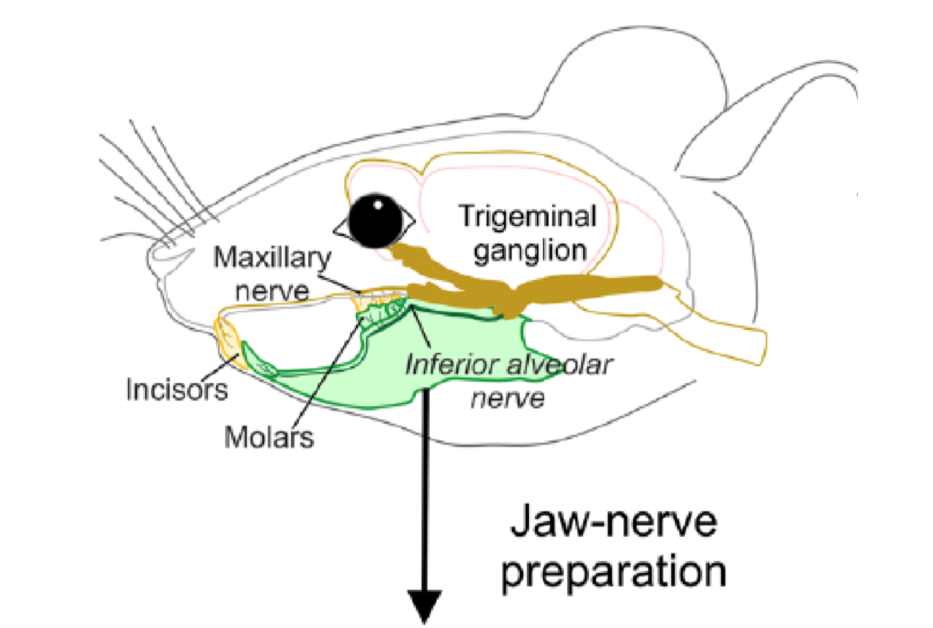
研究團隊將小鼠的牙齒系統放入冰涼的液體後,他們透過觀察神經訊號,顯示小鼠的牙齒系統確實能感受到寒冷。然而,當他們加入神經阻斷劑,或者將小鼠的 TRCP5 破壞後,就不會產生顯示疼痛的訊號。這個研究結果證實了小鼠牙齒系統內的 TRCP5 能偵測寒冷的訊號。
研究團隊接著發現 TRCP5 會出現在小鼠牙齒系統中,牙本質靠近牙髓的交界處,而美國麻省總醫院的病理學家 Jochen Lennerz 也進一步證實了 TRCP5 也會出現在人類牙本質中。
另外他們也發現,TRCP5 是造成小鼠牙痛的重要因素,當小鼠牙齒有損傷後,牠們飲用糖水的頻率會降低,但只要破壞 TRCP5 後,即使牙齒損傷,也不影響小鼠飲用糖水的頻率。
綜合以上的發現,Zimmermann 認為 TRCP5 是小鼠牙齒系統內,偵測寒冷並傳遞疼痛訊號的關鍵蛋白質。
敏感性牙齒:液體移動 vs. 刺激蛋白?
雖然 TRP 蛋白主要受溫度刺激,但正如前文所說,一些化學物質也能刺激 TRP 蛋白。
Zimmermann 表示,溫度、化學物質、撞擊等都可以活化 TRCP5 蛋白,因此她認為比起牙本質小管內液體移動這個假說,TRCP5 的活化更有可能是引起敏感性牙齒的主因。
當牙本質失去琺瑯質的保護後,各種外界因素就非常容易刺激 TRCP5 並使其活化,進而讓人產生牙齒的痠痛感,不過她也表示,這個想法需要更多實驗才能被證實。
牙痛和敏感性牙齒雖然不是一個熱門的研究主題,但它對我們其實頗重要,俗話說:「牙痛不是病,痛起來要人命!」我們每個人或多或少都經歷過牙痛,也都知道那種難受,而這篇研究揭示了一個可能引起敏感性牙齒的分子機制,因此未來只要能專一的封鎖 TRCP5,也許就有機會有效治療敏感性牙齒了。
另外這篇研究也解釋了一個古老的治牙痛處方——丁香油的作用機制。
人類很早就知道,在牙齒上塗上丁香油,能有效緩解牙痛,目前研究已知,丁香油酚是其中的有效物質,但為何有效至今仍是謎。

而這篇研究也發現,丁香油酚可以抑制 TRCP5 的活化,或許這就是丁香油緩解牙痛的原因,但正如前文所說,一切都還有待更多的研究來證實。Zimmermann也希望他們的研究,能給其他研究人員提供治療敏感性牙齒與牙痛的新思路。
參考資料
- Bernal L, Sotelo-Hitschfeld P, König C, Sinica V, Wyatt A, Winter Z, Hein A, Touska F, Reinhardt S, Tragl A, Kusuda R, Wartenberg P, Sclaroff A, Pfeifer JD, Ectors F, Dahl A, Freichel M, Vlachova V, Brauchi S, Roza C, Boehm U, Clapham DE, Lennerz JK, Zimmermann K. Odontoblast TRPC5 channels signal cold pain in teeth. Sci Adv. 2021 Mar 26;7(13):eabf5567.
- 台灣民眾「超敏感」不到3人就有1人敏感齒
- 牙齒
- Ji wonKim, Joo-CheolPark. Dentin hypersensitivity and emerging concepts for treatments. Journal of Oral Biosciences. Volume 59, Issue 4, November 2017.
- How Teeth Sense the Cold





















