夏天除了悶熱外,最令人厭惡的就是被蚊子叮咬!
能夠讓戶外的玩樂瞬間成了抓癢大會的昆蟲,除了蚊科的家蚊及斑蚊外,還有蠓科的小黑蚊(臺灣鋏蠓;Forcipomyia taiwana)肆虐。大家對於蚊子一定不陌生,但到底蠓是什麼呢?蠓屬於雙翅目(Diptera)下的蠓科(Ceratopogonidae),而鋏蠓屬中又有超過 137 種會吸血。
蠓的體型較蚊子小(約 1-3 mm),主要在泥土或潮濕土壤繁殖,飛行能力較差。蠓並非主要的疾病傳播病媒,但依舊有可能傳播病毒與寄生蟲。
蚊子吸血,嗜蚊庫蠓吸蚊子吸到的血
台灣最常見也最受注意的的蠓科成員,大約就是小黑蚊──台灣鋏蠓,但其實還有另一屬的蠓科成員──庫蠓屬(Culicoides)已被報導有超過 1500 種會吸血。根據臺灣物種名錄 4,目前記載臺灣有 63 種庫蠓現蹤。,庫蠓主要吸血的時段有兩個時間點,主要為日落前一小時至日落後兩小時,另一個高峰期為日出前。雌性的蠓吸血後才會產卵繁衍後代,主要的吸血對象為鳥類、兩棲類以及哺乳類動物如:豬、牛、羊、馬等等。
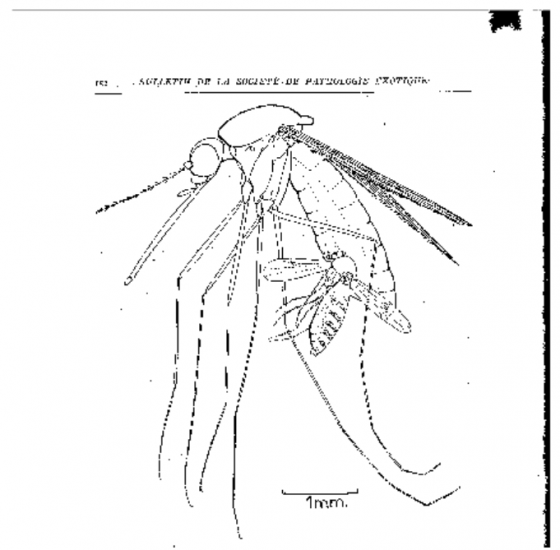
但庫蠓屬最特別的,是在野外調查的研究中居然發現,有種庫蠓──嗜蚊庫蠓(Culicoides anophelis)──會去叮咬已飽餐一頓的蚊子。為了繁衍後代,生物將無所不用其極!

這樣的行為最早在 1922 年由 Edwards 所發現,他在野外採集的埃及斑蚊、瘧蚊、叢蚊及三斑家蚊等蚊子,發現其腹部有這種特別的庫蠓附著,時間可長達 48 到 56 小時之久。為何會吸這麼久呢?研究者認為應該是庫蠓口器的特殊結構,為了讓牠能穩定插入蚊子腹部(尾部算起第三到四節)吸血,所以很難拔出,必須旋轉身體才能順利脫離。目前已知至少有 19 種蚊子會被嗜蚊庫蠓叮咬!
- 嗜蚊庫蠓叮咬蚊子的影片。
嗜蚊庫蠓主要分布於中國廣東、福建、海南,臺灣、印度及東南亞國家。目前並未報導過有叮咬人類的紀錄,所以不需擔心!但由於牠所叮咬的對象是常見的病媒蚊,所以是否會傳播登革熱、日本腦炎等病毒或其它微生物仍然需進一步的研究。
不會叮人卻是畜牧病媒,庫蠓該如何防治?
庫蠓是畜牧場所經常發現的病媒昆蟲(叮咬人類的機率低,會吸人血的庫蠓較少見!),最常見的是嗜牛庫蠓(Culicoides oxystoma)、日本庫蠓(Culicoides niponensis) 、荒川庫蠓(Culicoides arakawae)等等。庫蠓的活動時期始於春天而在八月達到高峰後數量開始下降,在冬季時明顯減少。

畜牧場牛隻會因庫蠓的叮咬而感染牛流行熱病毒(bovine ephemeral fever virus),造成生病、跛足、產乳量下降等等,使得飼養者需要付出高額的醫療費用與成本,所以需要有效的防治庫蠓策略。主要的方法有三:第一為環境之清潔,將富含有機質的土壤糞便定期清潔(減少青苔、藻類等生成),並讓環境盡量乾燥以降低其孳生源數目。第二為在夜間利用燈光誘捕法並搭配除蟲菊脂殺蟲劑,有效降低庫蠓數目。最後則是給予牛隻施打疫苗來降低其發病機率!
每次被蚊子叮時都非常不悅,透過這些研究,才知道原來蚊子也會被叮!哈哈哈~你看看你~
參考資料
- 台灣有害生物管理協會
- Edwards FW: On some Malayan and other species of Culicoides, with a note on the genus Lasiohelea. Bull Entomol Res 1922, 13:161–167.
- A video clip of the biting midge Culicoides anophelis ingesting blood from an engorged Anopheles mosquito in Hainan, China
- 臺灣物種名錄
- 牛流行熱病媒蚊綜合防治策略
- 臺灣CDC台灣蟲媒監測與帶病原分析













