阿茲海默症可能來自遺傳嗎?
這個激進的想法,在一九八一年十月明尼蘇達州的倫納德.赫斯頓(Leonard Heston)醫師刊登一些令人震驚的觀察後,開始引起人們的注意。
他使用明尼蘇達州立醫院超過兩千具屍體解剖取得的大腦樣本,發現中年或「 早發型」阿茲海默症患者的親屬,在他們到了中年時也很可能患上此病。即使那些自認對遺傳學一無所知的人,也知道這具有遺傳上的意義;確實,赫斯頓並非第一位提出這項連結的人。一九五○年代,瑞典和瑞士醫師在查看具有失智症病史的家族就醫紀錄時,即發現了這個趨勢。但在那時,基因只被視為是提供人類生物學基本層面的實體,像是身高、體型與眼睛顏色,他們萬萬沒想到這會與錯綜複雜、變幻莫測的大腦有多少(如果有的話)關係。不論何種情況,那時基因仍是無法取得的分子,因此醫師們對此疾病的化學基礎更感興趣。
但是到了一九八○年代,DNA 雙螺旋來了又走,基因定序技術正順利進行。美國國家老齡研究所分子病理學家喬治.格倫納(George Glenner),決定好好利用赫斯頓的研究結果。
β 類澱粉蛋白是什麼?
格倫納外表看起來安靜保守、正式又疏離,帶有一頭波浪的銀色頭髮以及謙遜的凝視。當他在一九八三年開始研究阿茲海默症時,對大腦的瞭解並不多。許多神經科學家都視他為局外人。他於約翰霍普金斯大學接受訓練後,很快就對此疾病如何在細胞層面上發展十分著迷,因此選擇專攻病理學。格倫納對於類澱粉蛋白特別感到疑惑──他稱它為「 一個討人厭的物質」──並很快就不顧一切地想弄清楚它到底是什麼。

格倫納的使命感展現了鎖定蛋白斑乃是醫學界最佳機會的典型想法。沒有人真的確定是否它們造成疾病,或者它們是在神經元開始死亡之前或之後形成。也沒人知道它們比神經元內部的纖維纏結更該受到譴責或更無辜。然而,它們的存在需要答案:
證明它們不重要已變得跟證明它們很重要一樣迫切。
格倫納進入裝滿捐贈者大腦的冷凍室(最初的阿茲海默症「 大腦銀行」之一)著手開始工作,他機械化地切片並清理每一份樣本,連根拔起血管,挑撿出連結的組織,以化學方式壓碎所有剩餘物直到只剩下類澱粉蛋白為止。一年之後他終於萃取出形成蛋白斑核心的蛋白質,並稱它為 β 類澱粉蛋白,一個在日後三十年流傳於神經科學家之間的名詞。
格倫納接著又完成一項重大突破。在赫斯頓的研究中,注意到許多阿茲海默症病患的親屬家族中發生唐氏症的機率很高。此外,醫生們也發現:
幾乎每個患有唐氏症的人年屆中年時,皆死於與阿茲海默症驚人相似的失智症。
這些狀況明顯有某種連結,但那是什麼?
解碼 β 類澱粉蛋白和失智的關聯性
唐氏症乃是在第二十一對染色體上出現不正常額外複製的基因狀況,當格倫納開始檢查唐氏症病患的類澱粉蛋白時,他意識到其組成與阿茲海默症病患腦中發現的蛋白質是同樣的。這表示存在著某種完全未預料到的狀況。或許對某些人來說,身上即存在阿茲海默症的基因——而它就潛伏在第二十一號染色體的某處。
因此,當格倫納的結果一發表,科學家們便開始收集顯現了繼承阿茲海默症跡象的家族 DNA 樣本,並稱之為「 家族性」阿茲海默症。其中一個樣本來自一個龐大的英國裔加拿大家族,他們的祖先於一八三七年移民至加拿大;僅僅十八代便出現高達五十四例阿茲海默症案例。另有一個德國家庭六代中有二十個病例。一個俄羅斯家庭在六代中顯示出二十三個病例。一個義大利大家族,其家族成員廣布法國與美國,在八代中有四十八個病例。
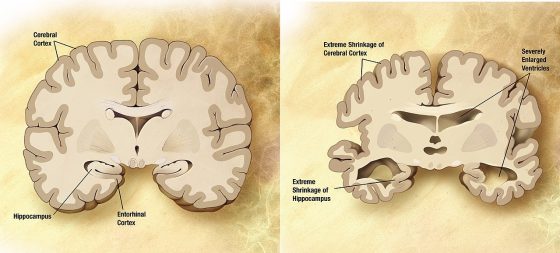
家族性阿茲海默症看起來與更普遍的非遺傳性版本完全相同;唯一值得注意的差異在於發作的年齡:
其症狀更早顯現,通常在五十幾歲、四十幾歲或甚至三十多歲末期。
家族性阿茲海默症之所以為革命性的發現,不只因為它證明阿茲海默症可能來自遺傳,還因為其基因起源對占多數的晚發型病症的顯現上,為科學家提供了一個真實的線索。科學家利用基因作為出發點,便能調查與它互動的其他分子,因而能開始拼湊出生化因果關係網。這就類似偵探在畫板上釘了一張黑手黨照片,用來對照出整個犯罪集團一樣。
到了一九八六年,接續格倫納的發現,數個美國團隊成功地解碼 β 類澱粉蛋白的 DNA 序列。他們將此基因命名為 APP(前類澱粉蛋白質,取自 amyloid precursor protein 的縮寫)。這讓科學家偵探們有了頭號嫌犯。但只有 APP 仍不足夠,他們需要查出它是否是從正常狀態被永久改變,才知道是否該將此基因定罪。要這麼做,他們需要找出突變。
和遺傳有關的家族性阿茲海默症
黑髮高挑、有著麻雀般面容以及細長眼睛帶著探究神情的卡蘿.詹寧斯,是位一眼便能看出問題的認真女性。她的父親沃爾特出身於勞動階級新教徒家庭,是十五名子女當中的長子。這位在戰時於海軍服役的送乳員,是個以勤奮工作來照顧其掌上明珠卡蘿的一絲不苟男人。他以健談、活潑性情以及管理家庭財務的細膩方式著稱,他經常會寫下事情,並從諾丁漢合作社追討每月帳款。

然而到了他五十八歲生日時,沃爾特變成「 不一樣的人」——安靜、不與人打交道,並很奇怪地無法整理他的帳本。有時候他似乎對最例行的任務也顯得迷迷糊糊:購物時常會拿起錯誤物品,然後放入別人的推車裡。家人帶他去看醫生後,被告知他得了失智症,很可能是阿茲海默症。至於成因或他不甚恰當的年紀,則沒有多加說明。
但沃爾特並不是唯一的一位:四位比他更年輕的弟弟妹妹在接近六十歲時,也開始出現一些症狀。諷刺的是,因為家族中有許多人這麼早就罹患了阿茲海默症,他們有許多人反而覺得這相當正常。但卡蘿不這麼想,她的信件不久後送達聖瑪麗醫院。在那裡,正於實驗室中工作的是二十八歲的分子遺傳學家艾莉森.高特(Alison Goate)。

高特是搜尋阿茲海默症突變的龐大團隊之一員。「 每個人都知道存在一些帶有遺傳性阿茲海默症的家族,」她以抑揚頓挫的腔調,從紐約透過電話告訴我。她現在就職於那裡的西奈山阿茲海默症研究中心(Mount Sinai Alzheimer’s Research Center)。「 但這些家族十分稀少,所以當時人們無法真正談論阿茲海默症的基因。」
卡蘿的故事振奮了他們,聖瑪麗醫院立即回應他們想知道更多,並且會安排醫生詢問問題並收集血液樣本。因此卡蘿連絡整個家族,要求他們全到她家提供樣本並告訴醫生所有知道的事。「 卡蘿讓我印象深刻,」高特說。「 她說服家族成員參與的方式,就像個啦啦隊隊長。」那麼多的姑姑與叔叔,還有表親、姪子姪女們,真的塞滿了整個房子。
尋找導致失智的突變 DNA 片段
場景回到倫敦,對基因突變的追捕已然展開。而這有賴於利用遺傳學的關鍵原則:染色體上彼此靠在一起的基因有一起繼承的傾向——即具有基因連結。這表示,如果在帶有失智症病史的家族中總可以看到某些 DNA 片段,我們便可推斷在那一區域的 DNA 某處藏有突變。如果這俗稱的 DNA 搜尋引擎發揮效用,將可迎向個人化的醫學新時代。針對某項遺傳缺陷的治療方式,將有可能修好問題的根本成因,徹底戰勝塔克寧這類藥物。「 乙醯膽鹼藥物之所以被核准,是因為沒有別的藥物,」高特說。「 對某些人來說,有總比沒有好,但它們只是治療症狀而非病因。而你的基因傾向,可以建議你該服用哪種藥物。」
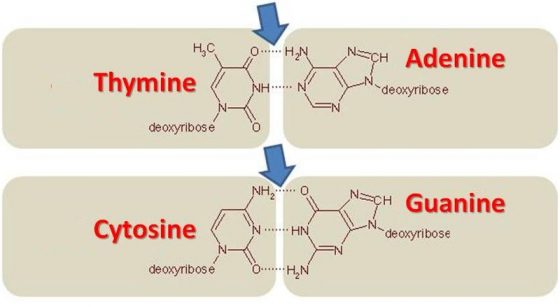
即使如此,找出突變並不容易。雖然 DNA 只是由四組重複化學群組構成的簡單分子──腺嘌呤(Adenine,簡稱 A)、胸腺嘧啶(Thymine,簡稱 T)、胞嘧啶(Cytosine,簡稱 C)以及鳥糞嘌呤(Guanine,簡稱 G)──其編碼相當於人類三十億個字母長。若寫出來,將等同於兩百本一千頁的書冊,一個打字員若每天工作八小時,則需要半個世紀才能完成。如何寄望誰可以找出其中的拼字錯誤?幸好,與唐氏症的連結以及 APP 基因位於何處,讓高特有一個好的出發點:第二十一對染色體。
僅僅四年後,在一九九一年二月,高特便發現了突變之處。它是 DNA 編碼的單一字母──原本應該是 C 卻成了 T。三十億的字母只需一個突變便足以瓦解卡蘿的家人。如果有任何領域可讓身處於混沌未明世界的我們真心感激的,肯定是遺傳學。
——本文摘自《當大腦開始崩壞:科學 X 人性 X 歷史,人類對阿茲海默症的奮戰》,2018 年 6 月,八旗文化。