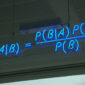泛科學「拜見科學界女力」系列專訪正式上線,讓我們和台灣的傑出女科學家們約個會,看這些在科學領域發光發熱的女力,如何顛覆以往以男性為主的科學戰場,綻放自己的光芒!
第一站泛科學來拜訪這次得到 2016 年台灣女科學家「傑出獎」,現在是中央研究院生物化學研究所研究員的陳瑞華。
陳瑞華投入研究工作二十餘年,專注在與癌症相關的訊息傳遞和蛋白質修飾研究,探討癌組織中抑癌、致癌機制的運作模式。她的研究成果不僅獲得如 Nature Cell Biology、Cancer Cell、Molecular Cell 等國際期刊刊登,也受到論文評論網站、期刊的好評和推薦。除此之外,她也是獲得教育部、科技部等單位的學術獎項鼓勵,更是李天德卓越醫藥科技獎、台灣生技醫藥發展基金會學術講座的第一位女性科學家。
「我做什麼事情其實沒有太大的規劃,就是看興趣。」陳瑞華滿臉笑容的她說走上科學研究這條路完全就是因為興趣。只是從興趣開始要延續到變成耕耘一輩子的專業,這一路怎麼走來,就更讓人好奇。

現在普遍的技術 當時卻步步艱難
陳瑞華進入台灣大學生物化學所後,跟著呂勝春老師做實驗,也順著當時生物研究趨勢,一腳踏入還在發展初期的分子生物學領域。即便呂勝春老師已是台灣最早踏入分子生物學的研究人員,但對於這些新興的研究技術仍不是非常熟悉。現在生物實驗室常用的實驗技術,像是複製 DNA(DNA cloning)在當時會的人很少,甚至在台灣都還沒有人碰過,陳瑞華就說,當時就是靠著手上的一張實驗流程表自己想辦法找出實驗該怎麼做。
陳瑞華說自己當時的碩士論文題目就是建立一個 cDNA 庫(cDNA library),也就是將製作成蛋白質的所有 DNA序列建立出來。在 DNA 轉錄成 RNA,RNA 轉譯為蛋白質的過程中,並非所有 DNA 最後都會形成蛋白質,而透過 cDNA 庫的建立,能讓科學家找到這些蛋白質所對應的 DNA 序列。建立 cDNA 庫在現在已不是相當困難的技術,也不可能成為一個碩士論文題目,但在當時卻讓陳瑞華傷透腦筋。

「那時候差一點就無法畢業!」陳瑞華說,好險的是最後呂勝春老師出手求救,讓她在畢業前夕及時換研究題目,為了趕實驗進度每天從早上 7 點開始做實驗,一路做到晚上 11 點,她開玩笑地說,這就像是最初 7-11 便利商店最初名稱由來一樣。但這樣的日子雖然辛苦,卻也讓她從實驗中找到了挑戰自我的成就感,以及對研究中「發現未知」的興趣。不僅及時完成了論文,也順利在畢業後將 cDNA 庫建立起來。
巧遇DNA修復大師 研究方向卻因此轉彎
要繼續走這條路,當時最好的方法就是出國深造。那個時候台灣並沒有太多相關的博士班,甚至連碩士班研究生都很少,不如現在許多學校都有生醫相關研究單位。北部各校生物領域的研究生卻也因此更為團結,十幾個學生自主成立了讀書會,陳瑞華就是其中一員。讀書會每周末聚會一次,每次由一個人負責報告一篇學術論文,藉此可以聽到不同領域的最新研究,又可以相互討論、學習。陳瑞華到美國念博士班時,才發現這個讀書會無形累積了自己的基礎,課堂上教的內容她「連原始論文都看過了」。
陳瑞華博士班選擇研究致癌物質對 DNA 產生的影響和 DNA 修復機制,四年順利畢業。她在離畢業剩下半年時,開始尋找接下來博士後研究的實驗室,一直以為自己會繼續在「DNA 修復」繼續研究下去,卻在遇到一個人後徹底改變。這個人是 Philip Hanawalt,DNA 修復研究領域的大師級人物,也是美國科學院院士。「當時他不認識我,但知道我在做的研究工作。」陳瑞華抱著希望,告訴 Hanawalt 自己即將在半年內畢業,也正在找博士後研究的實驗室。只是陳瑞華一心期待 Hanawalt 能告訴自己「那就來我的實驗室吧!」但等到的卻是「我建議你換一個領域,這樣你才能學到新的東西。」陳瑞華說,當時 Hanawalt 非常誠懇地這麼說,卻也讓她的研究路走向了一個全新的領域——訊息傳遞。
癌症中的訊息傳遞
人和人透過語言傳遞訊息,達到相互溝通的目的,然而在所有生物的體內不同的細胞、組織、器官間其實也需要透過「訊息」來溝通,當訊息內的一個步驟出了差錯,有可能造成嚴重的後果。「我會喜歡訊息傳遞這個領域,是因為這個學問很邏輯。」陳瑞華說。訊息傳遞的研究希望找到細胞內不同的分子如何相互影響,促進或抑制其它分子的功能,漸漸可以建構出一個訊息網絡。陳瑞華說自己從來不是一個善於研發新技術的研究人員,但她很喜歡系統性、邏輯性的推導過程,讓她和她的團隊能夠去發現一些目前未明朗的問題。
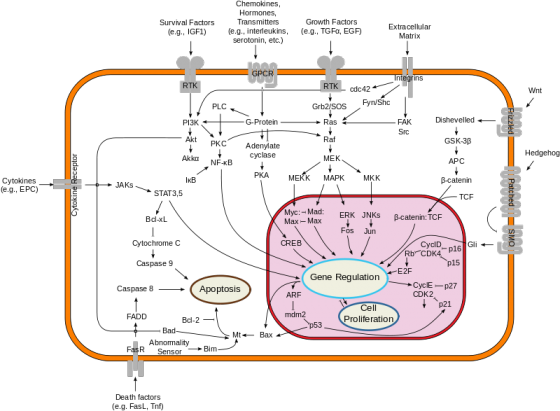
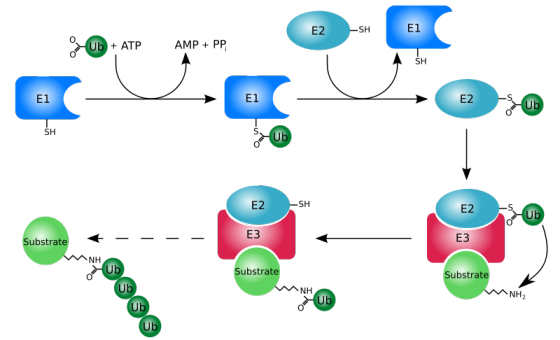
後來,陳瑞華融合了最初博博士班所研究的癌症和訊息傳遞兩個領域發展研究題目,也就是蛋白質泛素化(ubiquitination)的過程怎麼調控腫瘤的微環境。她進一步解釋,現在研究人員認為腫瘤中不只有癌細胞,旁邊還會有一些其他細胞,包括免疫細胞、纖維母細胞(fibroblast),和非細胞的物質等,它們會與癌細胞互利共生。泛素化的過程細胞內標記要清除的蛋白質的方式,透過泛素轉接酶的幫忙將泛素接到蛋白質上,讓這個蛋白質被分解。而細胞中就有一群抑癌蛋白質,它們能阻止癌細胞擴散,但陳瑞華就發現有一種稱為 KLHL20 的泛素轉接酶會造成抑癌蛋白質被降解,造成癌症惡化和轉移。
此外,陳瑞華也試著去了解癌細胞中一群長很快、很難殺死的細胞——癌幹細胞,看泛素化在腦癌幹細胞上一些功能的調控。甚至後來在她一個學生的建議下,開拓非癌症相關的研究,他們也發現了協助將泛素從蛋白質上移除的酶,會影響胚胎幹細胞分化為神經細胞的過程,現在這部分的實驗也已從單純細胞操作,進展到小鼠活體實驗。
近期他們也開始關注癌細胞與正常細胞中 RNA 的差異。我們知道 DNA 會轉錄成 RNA,而 RNA 轉譯成蛋白質,但事實上只有部分 RNA 才會真正轉譯成蛋白質,那些沒轉錄的 RNA 以往都被認為是無用的「垃圾」。不過,陳瑞華說現在大家也開始試著了解這些沒有轉錄的 RNA,在生物體內扮演的角色,而她自己的團隊也才剛開展這個研究。
做自己喜歡的研究 對自己和學生負責

當時從美國回到台灣,陳瑞華說其實自己心裡也有很多掙扎,一來自己很喜歡美國的尖端學術環境,二來舊金山的環境也相當宜人,讓人捨不得離開。但為了家人,陳瑞華選擇回台灣重新開始,並告訴自己「既然回來了,就要在這裡生根,要適應所有的環境」。當她回到台灣開始建立自己實驗室時,不僅要想實驗室要怎麼建置,還帶著兩個出生不久的孩子。「那時候簡直亂成一團。」不過陳瑞華說,現在的她也很慶幸自己回來了,培育一批屬於台灣的專業人才,像是陽明大學生化所的郭津岑、王琬菁老師都是陳瑞華早期的學生。
「每個實驗都是我的驕傲」陳瑞華說,雖然現在實驗室開展了多個方向的研究,但每一個研究都是重要的,她保持這樣的態度「不僅是對自己負責,也是對學生負責。」雖然不是每個研究都能被肯定或順利有結果,但至少要做到做自己喜歡的研究,以及讓學生受到好的訓練。
陳瑞華回憶在農化系就讀時,班上的男、女生人數各半,但系上從講師到教授清一色都是男性,這個現象也曾讓她疑惑女科學家都去哪裡了?經過這約二十年的研究生涯,她說自己雖然未因為自己是女性而在這個領域吃虧,但她也認為女性參與科學較容易受到家庭、育兒等因素面臨壓力。依據聯合國教科文組織的統計科學研究者中只有 28% 是女性,而在臺灣大專院校科學領域教職員也只有 22% 為女性。陳瑞華希望多加鼓勵這些有意參與科學研究的女學生,讓更多女性能夠成為優秀的科研人才。